Az egészségügyről szóló 1997. évi CLIV. törvény 247. §-a (2) bekezdésének da) pontjában kapott felhatalmazás alapján a következőket rendelem el:
1. § (1) A külön jogszabály szerinti kozmetikai termékekből történő mintavétel, a vizsgálati minták laboratóriumi előkészítése, a szabad nátrium- és kálium-hidroxid tartalmának azonosítása és meghatározása, az oxálsavak és alkálisóinak hajápolási termékekben történő azonosítása és meghatározása, a kloroform és a cink fogkrémekben történő meghatározása, továbbá a fenolszulfonsav azonosítása és meghatározása vizsgálati módszerét az 1. számú melléklet tartalmazza.
(2) A külön jogszabály szerinti kozmetikai termékekben lévő oxidálószer azonosításának, a hidrogén-peroxid kozmetikai hajápolási termékekben történő mennyiségi meghatározásának, bizonyos oxidáló színezékek hajfestékekben történő azonosításának és félkvantitatív meghatározásának, nitrit azonosításának és mennyiségi meghatározásának, a szabad formaldehid azonosításának és mennyiségi meghatározásának, a rezorcin samponokban és hajszeszekben történő mennyiségi meghatározásának és a metanol etanolra vagy propán-2-olra vonatkoztatott mennyiségi meghatározásának vizsgálati módszerét a 2. számú melléklet tartalmazza.
(3) A külön jogszabály szerinti kozmetikai termékekben lévő diklór-metán és 1,1,1-triklór-etán mennyiségi meghatározására, a 8-kinolin-ol (8-hidroxi-kinolin) és a bis(8-hidroxi-kinolinium)-szulfát azonosítására és mennyiségi meghatározására, az ammónia mennyiségi meghatározására, a nitrometán azonosítására és mennyiségi meghatározására, a tioglikolsav azonosítására és mennyiségi meghatározására a hajhullámosító, a hajkiegyenesítő és a szőrtelenítő termékekben, a hexaklorofén azonosítása és meghatározása, a tozil-klóramid-nátrium (INN) (klóramin-T) azonosítására és mennyiségi meghatározására, az összes fluor fogkrémekben való meghatározására, a szerves higanyvegyületek azonosítására és mennyiségi meghatározására, alkáli- és alkáliföld-szulfidok mennyiségi meghatározására vonatkozó vizsgálati módszereket a 3. számú melléklet tartalmazza.
(4) A külön jogszabály szerinti kozmetikai termékekben lévő 1-glicerin-(4-amino)-benzoát azonosítására és mennyiségi meghatározására, a klórbutanol mennyiségi meghatározására, a kinin azonosítására és mennyiségi meghatározására, a szervetlen szulfitok és higrogénszulfitok azonosítására és mennyiségi meghatározására, az alkálifémek klorátjainak azonosítására és mennyiségi meghatározására, valamint a nátrium-jodát azonosítására és mennyiségi meghatározására vonatkozó vizsgálati módszereket a 4. számú melléklet tartalmazza.
(5) A külön jogszabály szerinti kozmetikai termékekben lévő ezüstnitrát azonosítására és mennyiségi meghatározására, a szelén-diszulfid azonosítására és mennyiségi meghatározására a korpásodás elleni samponokban, az oldható bárium és az oldható stroncium mennyiségi meghatározására festékekben (pigmentekben) sók vagy festéklakkok formájában, a benzil-alkohol azonosítására és mennyiségi meghatározására, a cirkónium azonosítására, a cirkónium, alumínium és klór mennyiségi meghatározására nem aeroszol izzadásgátlókban, valamint a hexamidin, dibróm-hexamidin, dibróm-propamidin és klór-hexidin azonosítására és mennyiségi meghatározására vonatkozó vizsgálati módszereket az 5. számú melléklet tartalmazza.
(6) A külön jogszabály szerinti kozmetikai termékekben lévő benzoesav, 4-hidroxibenzoesav, szorbinsav, szalicilsav és propionsav, valamint hidrokinon, hidrokinon monometil-éter, hidrokinon monoetil-éter és hidrokinon monobenzil-éter azonosítására és mennyiségi meghatározására vonatkozó vizsgálati módszereket a 6. számú melléklet tartalmazza.
(7) A külön jogszabály szerinti kozmetikai termékekben lévő 2-fenoxietanol, 1-fenoxipropán-2-ol, metil-, etil-, propil-, butil- és benzil-4-hidroxibenzoát azonosítása és mennyiségi meghatározására vonatkozó vizsgálati módszereket a 7. számú melléklet tartalmazza.
2. § E rendelet a Magyar Köztársaság és az Európai Közösségek és azok tagállamai közötti társulás létesítéséről szóló, Brüsszelben, 1991. december 16-án aláírt Európai Megállapodás tárgykörében a Megállapodást kihirdető 1994. évi I. törvény 3. §-ával összhangban az Európai Közösség alább felsorolt irányelveivel összeegyeztethető szabályozást tartalmaz:
– a Bizottság 80/1335/EGK első irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges vizsgálati módszerekre vonatkozó tagállami jogszabályok közelítéséről,
– a Bizottság 87/143/EGK irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges vizsgálati módszerekre vonatkozó tagállami jogszabályok közelítéséről szóló első 80/1335/EGK irányelv módosításáról,
– a Bizottság 82/434/EGK második irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges vizsgálati módszerekre vonatkozó tagállami jogszabályok közelítéséről,
– a Bizottság 90/207/EGK irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges vizsgálati módszerekre vonatkozó tagállami jogszabályok közelítéséről szóló 82/434/EGK második irányelv módosításáról,
– a Bizottság 83/514/EGK harmadik irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges elemzési módszerekre vonatkozó tagállami jogszabályok közelítéséről,
– a Bizottság 85/490/EGK negyedik irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges vizsgálati módszerekre vonatkozó tagállami jogszabályok közelítéséről,
– a Bizottság 93/73/EGK ötödik irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges elemzési módszerekről,
– a Bizottság 95/32/EK hatodik irányelve a kozmetikai termékek összetételének ellenőrzéséhez szükséges elemzési módszerekről,
– a Bizottság 96/45/EK hetedik irányelve a kozmetikai termékek összetételének megállapításához szükséges elemzési módszerekről.
3. § Ez a rendelet a Magyar Köztársaságnak az Európai Unióhoz történő csatlakozásáról szóló nemzetközi szerződést kihirdető törvény hatálybalépésének napján lép hatályba.
1. Cél és alkalmazási terület
A kozmetikai termékek mintavételi eljárása a különböző laboratóriumokban történő vizsgálatuk céljából kerül leírásra.
2. Fogalommeghatározások
2.1. Elemi minta:
az értékesítésre szánt tételből vett mintaegység.
2.2. Összes minta:
az azonos tételszámmal rendelkező elemi minták összessége.
2.3. Laboratóriumi minta:
az összes mintának az egyes laboratóriumokban vizsgálandó reprezentatív része.
2.4. Vizsgálati minta:
a laboratóriumi mintából az egy elemzéshez szükséges reprezentatív adag.
2.5. Tárolóedény:
a terméket magába foglaló, vele folyamatosan, közvetlenül érintkező tárgy.
3. Mintavételi eljárás
3.1. A kozmetikai termékeket eredeti csomagolásukban mintázzák, és ilyen formában juttatják el az analitikai laboratóriumba.
3.2. A nem kimért adagokban kereskedelmi forgalomba hozott, vagy a kiskereskedelemben az eredeti csomagolástól eltérő tárolóedénybe átcsomagolt kozmetikai termékek esetében különleges mintavételi szabályok kerülnek megállapításra.
3.3. A laboratóriumi minta elkészítéséhez szükséges elemi minták számát az analitikai módszer és az egyes laboratóriumok által elvégzendő vizsgálatok száma határozza meg.
4. A minta azonosítása
4.1. A mintákat a mintavétel helyén lezárják, és a mintavétel helye szerinti tagállamban hatályban levő szabályoknak megfelelően azonosítással látják el.
4.2. Minden kivett elemi mintán a következő adatokat tartalmazó címkét helyeznek el:
– a kozmetikai termék neve,
– a mintavétel kelte, időpontja és helye,
– a mintavételért felelős személy neve,
– az ellenőrzést végző hatóság neve.
4.3. A mintavételről a mintavétel helye szerinti tagállamban hatályban levő szabályoknak megfelelő jegyzőkönyvet kell felvenni.
5. A minták tárolása
5.1. Az elemi mintákat a gyártó címkén szereplő tárolási utasításainak megfelelően kell tárolni.
5.2. Ha nem határoznak meg más körülményeket, a laboratóriumi mintákat sötét helyen, 10 °C és 25 °C között tárolják.
5.3. Az elemi mintákat csak a vizsgálat kezdetekor szabad kinyitni.
1. Általános rendelkezések
1.1. Ahol lehetséges, a vizsgálatot minden elemi mintán elvégzik, vagy – ha az elemi minta mennyisége túl kicsi – a szükséges legkisebb számú elemi mintát használják, és ezeket a vizsgálati minta kivétele előtt alaposan összekeverik.
1.2. A tárolóedényt – ha az analitikai módszer úgy kívánja inert gáz alatt – kinyitják, és a lehető leggyorsabban kiveszik a szükséges számú vizsgálati mintát, ezután késlekedés nélkül lefolytatják a vizsgálatot. Ha a mintát meg kell őrizni, az edényt ismét légmentesen le kell zárni inert gáz alatt.
1.3. A kozmetikai termékek háromféle halmazállapotban fordulhatnak elő: szilárd, félszilárd, folyékony. Előfordulhat, hogy az eredetileg homogén állapotú terméknél a különböző fázisok során szétválás tapasztalható. Ebben az esetben újra kell ezeket homogenizálni.
1.4. Amennyiben a kozmetikai termék különleges módon csomagolt, és emiatt nem lehet a fenti utasítások szerint eljárni, és megfelelő vizsgálati módszerek nem kerültek előírásra, elfogadható valamilyen egyedi eljárás alkalmazása, feltéve, hogy az analízisről készült jegyzőkönyvben ennek leírása szerepel.
2. Folyadékok
2.1. Ezek a termékek olajos, alkoholos és vizes oldatok, kölnivizek, krémek vagy tejek formájában fordulhatnak elő, és flakonokba, palackokba, ampullákba vagy tubusokba csomagolják őket.
2.2. Vizsgálati minta kivétele:
– kinyitás előtt rázzuk össze erőteljesen a tárolóedényt,
– nyissuk ki a tárolóedényt,
– öntsünk néhány milliliter folyadékot a vizsgálatra szolgáló kémcsőbe, hogy a minta jellegzetességeinek szemrevételezésével kivegyük a vizsgálati mintát,
– zárjuk vissza a tárolóedényt, vagy
– vegyük ki a kívánt mennyiségű vizsgálati mintákat,
– gondosan zárjuk vissza a tárolóedényt.
3. Félszilárd termékek
3.1. Ezek a termékek paszták, kenőcsök, sűrű emulziók és gélek formájában fordulhatnak elő, és tubusokba, műanyag palackokba vagy tégelyekbe csomagolják őket.
3.2. Vizsgálati minta kivétele:
Két eset lehetséges:
3.2.1. szűknyakú tárolóedények esetében: Távolítsuk el a vizsgált termék legalább felső 1 cm-ét. Nyomjuk ki a vizsgálati mintát, majd azonnal zárjuk le a tartályt.
3.2.2. széles nyakú tartályok esetében: A felső réteget egyenletesen kaparjuk le és távolítsuk el. Vegyük ki a vizsgálati mintát és azonnal zárjuk vissza a tárolóedényt.
4. Szilárd termékek
4.1. Ezek a termékek laza porok, kompakt porok, stiftek formájában fordulhatnak elő, és különféle tartóedényekbe csomagolhatják őket.
4.2. Vizsgálati minta kivétele:
Két eset lehetséges:
4.2.1. laza porok esetén: a dugó kivétele vagy a tárolóedény kinyitása előtt erőteljesen rázzuk össze a port. Nyissuk ki és vegyük ki a vizsgálati mintát.
4.2.2. tömörített por vagy stift esetén: egyenletesen kaparjuk le és távolítsuk el a felső réteget szilárd termékről, az így szabaddá váló részből vegyük ki a vizsgálati mintát.
5. Túlnyomásos csomagolásban forgalmazott termékek (aeroszolos flakonok)
5.1. Ezek definícióját a 75/324/EGK irányelv * 2. Cikke tartalmazza.
5.2. Vizsgálati minta:
Az aeroszolos flakon erőteljes felrázását követően a flakon tartalmának reprezentatív mennyiségét, megfelelő összekötőelem segítségével (lásd például az 1. ábrát: különleges esetekben az analitikai módszer más összekötőelem használatát teheti szükségessé), egy aeroszol szeleppel ellátott, de bemerülő csövet nem tartalmazó műanyag bevonatú, áttetsző üvegpalackba (4. ábra) juttatjuk. Az átvitel során a flakont szeleppel lefelé kell tartani. Az átvitel után tartalma jól látható, és az alábbi négy eset valamelyikének megfelelően viselkedik:
5.2.1. A flakon tartalma homogén oldat, amely közvetlenül vizsgálható.
5.2.2. A flakon két folyadékfázisú aeroszol terméket tartalmaz. Az alsó fázisnak egy második továbbító flakonba történő leválasztását követően mindkét fázis vizsgálata elvégezhető. Az első flakont ilyenkor szeleppel lefelé kell tartani. Az esetek többségében ilyenkor gyakran az alsó a vizes fázis és nem tartalmaz hajtógázt (pl. bután/víz receptura).
5.2.3. A flakon szuszpenzióban port tartalmaz. A folyadékfázis a por eltávolítását követően vizsgálható.
5.2.4. Hab vagy krém. Először mérjünk be pontosan a mintagyűjtő palackba 5–10 g 2-metoxi-etanolt. Ez az anyag a gázmentesítés során megakadályozza a habképződést, és ezután folyadékveszteség nélkül elvégezhető a hajtógázok kihajtása.
5.3. Segédeszközök
Az összekötőelem (1. ábra) dúralumíniumból vagy sárgarézből készül. Úgy van kialakítva, hogy egy polietilén adapteren keresztül különböző szeleprendszerekhez csatlakoztatható. A bemutatott eszköz példaként szolgál; más összekötőelemek is használhatók (lásd a 2. és 3. ábrát). A mintagyűjtő palack (4. ábra) kívül átlátszó, műanyag védőréteggel bevont opálüvegből készül. 50–100 ml minta befogadására alkalmas. A palack egy bemerülő cső nélküli aeroszol szeleppel van ellátva.
5.4. Eljárás
Megfelelő mennyiségű vizsgálati minta befogadása érdekében a mintagyűjtő palackot légteleníteni kell. Ehhez az összekötőelemen keresztül vezessünk be körülbelül 10 ml diklór-difluor-metánt vagy butánt (a vizsgálandó aeroszol terméktől függően), majd a mintagyűjtő palackot szeleppel fölfelé tartva teljesen gázmentesítsük a folyadékfázis eltűnéséig. Vegyük le az összekötőelemet és mérjük le a mintagyűjtő palackot („a” gramm). Erőteljesen rázzuk föl az aeroszolos flakont, amelyből a mintavétel történik. Csatlakoztassuk az összekötőelemet a mintául szolgáló aeroszolos flakonon levő szelephez (szelep fölfelé néz), illesszük a mintagyűjtő palackot (nyakkal lefelé) az összekötőelemhez, majd nyomjuk meg. Töltsük föl a mintagyűjtő palackot körülbelül kétharmad részig. Ha az átvitel a nyomás kiegyenlítődése miatt a kívánt szint elérése előtt megszűnik, a mintagyűjtő palack lehűtésével újra megindítható a folyamat. Vegyük le az összekötőelemet, mérjük meg a feltöltött palackot („b” gramm) és számítsuk ki az átvitt minta mennyiségét (m1) (m1 = b–a).
Az így kapott minta felhasználható:
1. a szokásos kémiai vizsgálat elvégzésére;
2. az illékony komponensek gázkromatográfiás analízisére.
5.4.1. Kémiai vizsgálat
A mintagyűjtő palackot szeleppel fölfelé tartva a következőképpen folytassuk a vizsgálatot:
– gázmentesítés. Ha a gázmentesítés habképződéssel jár, olyan mintagyűjtő palackot használjunk, amelybe az átvitelt megelőzően az összekötőelemen keresztül egy fecskendő segítségével pontosan lemért mennyiségű (5–10 g) 2-metoxi-etanolt adagoltunk be,
– vigyázva, hogy anyagveszteség ne történjék, teljesen távolítsuk el az illékony alkotókat 40 °C-os vízfürdőn rázatva a mintát. Vegyük le az összekötőelemet.
– ismét mérjük le a mintagyűjtő palackot („c” gramm) a maradék, mennyiségének meghatározásához (m2) (m2 = c-a),
(Megjegyzés: A maradék tömegének számítása során vonjuk le a bemért 2-metoxi-etanol tömegét.)
– a szelep levételével nyissuk ki a mintagyűjtő palackot,
– oldjuk fel a mintát hiánytalanul ismert mennyiségű, megfelelő oldószerben,
– a minta egy részéből végezzük el a kívánt vizsgálatot.
A számítási képletek:
| R = | r x m2 ─── m1 | és Q = | R x P ─── , 100 |
ahol
m1 = az aeroszol mennyisége a mintagyűjtő palackban;
m2 = a maradék mennyisége 40 °C-on történő rázatás után;
r = a vizsgált anyag százalékos aránya m2-ben (a megfelelő módszerrel meghatározva);
R = a vizsgált anyag százalékos aránya az aeroszol mintában;
Q = a vizsgált anyag összes tömege az aeroszolos flakonban;
P = a kiindulási aeroszolos flakon nettó tömege (elemi minta).
5.4.2. Az illékony komponensek gázkromatográfiás vizsgálata
5.4.2.1. Alapelv
Gázkromatográfiás fecskendővel vegyünk ki megfelelő mennyiségű anyagot a mintagyűjtő palackból. Ezután a fecskendőben található anyagot fecskendezzük be a gázkromatográfiás készülékbe.
5.4.2.2. Segédeszközök
25 és 50 μl-es, A2 sorozatba tartozó „precíziós mintavételre” megjelölésű vagy ezzel egyenértékű gázkromatográfiás fecskendő (5. ábra). A fecskendő a tű felőli végénél egy tolattyúval van ellátva. A fecskendő csatlakoztatása a mintagyűjtő palackhoz a palack felöli oldalon egy összekötőelemen, a fecskendőnél pedig egy (8 mm hosszú, 2,5 mm átmérőjű) polietilén csövön keresztül történik.
5.4.2.3. Eljárás
Miután a mintagyűjtő palackba átjutott a szükséges mennyiségű aeroszol termék, a fecskendő kúpos végét csatlakoztassuk az 5.4.2.2. pontban leírt módon a mintagyűjtő palackhoz. Nyissuk ki a szelepet és szívjuk fel a szükséges mennyiségű folyadékot. Távolítsuk el a gázbuborékokat a dugattyú többszöri ki-be mozgatásával (szükség esetén hűtsük le a fecskendőt). Amikor a fecskendőbe a szükséges mennyiségű buborékmentes oldat bekerült, zárjuk a szelepet és vegyük le a fecskendőt a mintagyűjtő palackról. Illesszük a fecskendőre a tűt és helyezzük be a gázkromatográf injektorába, nyissuk ki a szelepet és fecskendezzük be a mintát.
5.4.2.4. Belső standard
Ha a vizsgálathoz belső standard szükséges, azt a mintagyűjtő palackba kell beadagolni (összekötőelemen keresztül egy közönséges üvegfecskendő segítségével).
1. ábra
P1 összekötőelem
2. ábra
M2 összekötőelem
Külső és belső menetes szelepek közötti átvitelre
3. ábra
M1 összekötőelem
két külső menetes szelep közötti átvitelre

4. ábra
Mintagyűjtő palack
űrtartalom 50–100 ml

5. ábra
Gáznyomásos fecskendő
1. Cél és alkalmazási terület
Ez a módszer a jelentős mennyiségű szabad nátrium és/vagy kálium-hidroxidot tartalmazó kozmetikai termékek azonosítására, és a hajegyenesítő, valamint körömágybőr-eltávolító készítményekben az ilyen szabad nátrium- és/vagy kálium-hidroxid tartalom meghatározására szolgáló eljárást írja le.
2. Fogalommeghatározás
A szabad nátrium- és kálium-hidroxid tartalom a termék semlegesítéséhez szükséges sav mérő oldat térfogata meghatározott körülmények között. Az elért eredmény szabad nátrium-hidroxid formájában kerül megadásra.
3. Alapelv
A mintát vízben feloldjuk vagy diszpergáljuk és sav mérő oldattal titráljuk. A sav hozzáadása közben folyamatosan regisztráljuk a pH értékét: tiszta nátrium- vagy kálium-hidroxid oldat esetében a végpontot a regisztrált pH érték változási sebességének maximuma egyértelműen meghatározza.
Az egyszerű titrálási görbét a következő anyagok jelenléte torzíthatja:
a) ammónia és más gyenge szerves bázisok, amelyek titrálási görbéje meglehetősen lapos. Az ammónia eltávolítása szobahőmérsékleten csökkentett nyomáson történik;
b) gyenge savak sói, amelyek titrálási görbéje több inflexiós pontot is tartalmazhat. Ilyenkor, több inflexiós pont esetén a görbének csupán az első inflexiós pontig tartó első szakasza felel meg a szabad nátrium- és kálium-hidroxidból származó hidroxil ionok semlegesítésének.
Létezik egy alternatív eljárás alkoholos oldatban történő titrálása esetére akkor, ha gyenge szervetlen savak sói túlzott mértékben zavarják a meghatározást.
Elméletileg ugyan fennáll a lehetősége, hogy más erős bázisok oldata, például lítium-hidroxid vagy kvaterner ammónium-hidroxid okozza a magas pH-t, ezek jelenléte azonban ilyen típusú kozmetikai termékekben erősen valószínűtlen.
4. Azonosítás
4.1. Reagensek
4.1.1. Lúgos standard puffer oldat, 25 °C-on pH = 9,18: 0,05 M nátrium-tetraborát-dekahidrát.
4.2. Eszközök
4.2.1. Szokásos laboratóriumi üvegeszközök
4.2.2. pH mérő
4.2.3. Üvegelektród
4.2.4. Kalomel referencia elektród
4.3. Eljárás
A standard puffer oldat segítségével végezzük el az elektródok kalibrációját.
Készítsük el a vizsgálandó termék 10%-os vizes oldatát vagy diszperzióját és szűrjük meg. Mérjük meg a pH-t. Ha a pH 12 vagy azt meghaladó érték, mennyiségi meghatározást kell végezni.
5. Mennyiségi meghatározás
5.1. Titrálás vizes közegben
5.1.1. Reagens
7.2.1.1. 0,1 N sósav mérőoldat
5.1.2. Eszközök
5.1.2.1. Szokásos laboratóriumi üvegeszközök
5.1.2.2. pH mérő, lehetőleg regisztrálóval
5.1.2.3. Üvegelektród
5.1.2.4. Kalomel referencia elektród
5.1.3. Eljárás
Pontosan mérjünk be 0,5–1,0 g vizsgálati mintát egy 150 ml-es főzőpohárba. Amennyiben a mintában ammónia van, dobjunk néhány üveggyöngyöt a főzőpohárba, helyezzük a főzőpoharat vákuum exszikkátorba, és vízsugárszivattyúval vákuumozzuk, amíg az ammóniaszag meg nem szűnik (kb. három óra).
Adjunk hozzá 100 ml vizet, oldjuk fel vagy diszpergáljuk a maradékot, és titráljuk (5.1.1.1.) 0,1 N sósav oldattal, regisztrálva a pH változását (5.1.2.2.).
5.1.4. Számítás
Állapítsuk meg a titrálási görbék inflexiós pontjait. Az első inflexiós pontnál, amikor az 7 pH alatt található, a mintában nincs nátrium- és kálium-hidroxid.
Ha a görbén két vagy több inflexiós pont figyelhető meg, csak az elsőt kell figyelembe venni.
Jegyezzük föl a titrálószer térfogatát az első inflexiós pontban.
Legyen
„V” a titrálószer térfogata ml-ben
„M” a vizsgálati minta tömege grammban.
A minta nátrium- és/vagy kálium-hidroxid tartalmát% (m/m) nátrium-hidroxidban kifejezve az alábbi képlettel számítjuk ki:
| % = 0,4 | V ─ M |
Előfordulhat, hogy bár a jelek szerint a mintában jelentős mennyiségű nátrium- és/vagy kálium-hidroxid van jelen, a titrálási görbén mégsem fedezhető fel határozott inflexiós pont. Ilyen esetben a mennyiségi meghatározást izopropanolban kell megismételni.
5.2. Titrálás izopropanolban
5.2.1. Reagensek
5.2.1.1. Izopropanol
5.2.1.2. 1,0 N sósav vizes mérőoldata
5.2.1.3. Az izopropanolos 0,1 N sósav oldat közvetlenül felhasználás előtt készítendő az 1,0 N vizes sósavoldat izopropanollal történő hígításával.
5.2.2. Eszközök
5.2.2.1. Szokásos laboratóriumi üvegeszközök
5.2.2.2. pH mérő, lehetőleg regisztrálóval
5.2.2.3. Üvegelektród
5.2.2.4. Kalomel referencia elektród
5.2.3. Eljárás
Pontosan mérjünk be 0,5–1,0 g vizsgálati mintát egy 150 ml-es főzőpohárba. Amennyiben a „mintában ammónia van, dobjunk néhány üveggyöngyöt a főzőpohárba, helyezzük a főzőpoharat vákuum exszikkátorba, és vízsugárszivattyúval vákuumozzuk, amíg az ammóniaszag meg nem szűnik (kb. három óra).
Adjunk hozzá 100 ml izopropanolt, oldjuk fel vagy diszpergáljuk a vákuumozás maradékát, és titráljuk (5.2.1.3.) 0,1 N sósavas izopropanollal, regisztrálva a látszólagos pH változását (5.2.2.2.).
5.2.4. Számítás
Az 5.1.4. pontot szerint. Az első inflexiós pont helye 9 körüli látszólagos pH-nál van.
5.3. Ismételhetőség *
Nátrium-hidroxidban kifejezve 5% (m/m) körüli nátrium- vagy kálium-hidroxid-tartalom esetén, az azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értéke nem haladhatja meg a 0,25%-ot.
1. Cél és alkalmazási terület
Az alábbiakban leírt módszer alkalmas oxálsavnak és alkálisóinak hajápolási termékben történő mennyiségi meghatározására és azonosítására. A módszer körülbelül 5% oxálsavat vagy ezzel azonos mennyiségű alkáli-oxalátot tartalmazó színtelen, vizes/alkoholos oldatok és bőrlemosó-folyadékok esetében alkalmazható.
2. Fogalommeghatározás
A minta oxálsav és/vagy alkáli-oxalát tartalmát ennek az eljárásnak megfelelően adjuk meg, és a szabad oxálsav tömegszázalékban (m/m) fejezzük ki.
3. Alapelv
Az esetleg jelenlevő anionos felületaktív anyagok p-toluidin hidro-kloriddal történő eltávolítását követően az oxálsavat és/vagy az oxalátokat kalcium-oxalát formájában kicsapatjuk, majd az oldatot szűrjük. A csapadékot kénsavban feloldjuk és kálium-permanganáttal titráljuk.
4. Reagensek
Valamennyi reagensnek analitikai tisztaságúnak kell lennie.
4.1. 5% (m/m) ammónium-acetát oldat
4.2. 10% (m/m) kalcium-klorid oldat
4.3. 95%-os (V/V) etanol
4.4. szén-tetraklorid
4.5. dietil-éter
4.6. 6,8% (m/m) p-toluidin-dihidroklorid oldat
4.7. 0,1 N kálium-permanganát oldat
4.8. 20% (m/m) kénsav
4.9. 10% (m/m) sósav
4.10. nátrium-acetát-trihidrát
4.11. jégecet
4.12. (1:1) kénsav
4.13. telített bárium-hidroxid oldat
5. Eszközök
5.1. 500 ml-es választótölcsér
5.2. 50 ml-es és 600 ml-es főzőpohár
5.3. G-4 üvegszűrő
5.4. 25 ml-es és 100 ml-es mérőhenger
5.5. 10 ml-es pipetta
5.6. 500 ml-es szívópalack
5.7. Vízsugárszivattyú
5.8. 0–100 °C közötti beosztású hőmérő
5.9. Fűthető mágneses keverő
5.10. Teflonbevonatú mágneses keverő pálcák
5.11. 25 ml-es büretta
5.12. 250 ml-es Erlenmeyer lombik
6. Eljárás
6.1. Mérjünk be 6–7 g mintát egy 50 ml-es főzőpohárba, állítsuk be pH-ját 3-ra hígított sósavval (4.9.) és mossuk be 100 ml desztillált vízzel egy választótölcsérbe. Ezután adjunk hozzá 25 ml etanolt (4.3.), 25 ml p-toluidin-dihidroklorid (4.6.) oldatot és 25–30 ml szén-tetrakloridot (4.4.), majd erőteljesen rázzuk össze a keveréket.
6.2. A fázisok szétválása után távolítsuk el az alsó (szerves) fázist, ismételjük meg az extrakciót a 6.1. pontban leírt reagensekkel és újra távolítsuk el a szerves fázist.
6.3. Mossuk a vizes oldatot egy 600 ml-es főzőpohárba, és az oldat forralásával távolítsuk el a visszamaradt szén-tetrakloridot.
6.4. Adjunk hozzá 50 ml ammónium-acetát (4.1.) oldatot, forraljuk az (5.9.) oldatot, és keverjünk be 10 ml forró kalcium-klorid (4.2.) oldatot a forrásban levő oldatba; hagyjuk kiülepedni a csapadékot.
6.5. Ellenőrizzük, hogy teljes-e a csapadék leválása néhány csepp kalcium-klorid (4.2.) oldat hozzáadásával, hagyjuk lehűlni szobahőmérsékletre, majd keverjünk bele 200 ml etanolt (4.3.); (5.10.), hagyjuk állni 30 percet.
6.6. Szűrjük a folyadékot (5.3.) üvegszűrő tégelyen. Vigyük át a csapadékot kismennyiségű forró vízzel (50–60 °C) a szűrőtégelybe, és mossuk a csapadékot hideg vízzel.
6.7. Mossuk a csapadékot ötször, kismennyiségű etanollal (4.3.), majd ötször kismennyiségű dietil-éterrel (4.5.), és oldjuk fel 50 ml forró kénsavban (4.8.) úgy, hogy utóbbit vákuummal átszívatjuk a szűrőtégelyen.
6.8. Vigyük át az oldatot veszteség nélkül egy (5.12.) Erlenmeyer lombikba, majd titráljuk kálium-permanganát (4.7.) oldattal halvány rózsaszín szín megjelenéséig.
7. Számítás
A minta tömegszázalékban kifejezett oxálsav-tartalmát az alábbi képlettel számítjuk:
| %oxálsav = | A x 4,50179 x 100 ──────── E x 1000 |
ahol:
A 0,1 N kálium-permanganát fogyása a 6.8. pont szerint mérve
E a (6.1.) vizsgálati minta mennyisége grammban;
4,50179 az oxálsav átszámítási faktora.
8. Ismételhetőség *
5% (m/m) körüli oxálsav tartalom esetén az azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értékben nem haladhatja meg a meg a 0,15%-ot.
9. Azonosítás
9.1. Alapelv
Az oxálsavat és/vagy az oxalátokat kalcium-oxalát formájában kicsapatjuk és kénsavban feloldjuk. Az oldathoz kevés kálium-permanganát oldatot adunk, amely szén-dioxid képződése közben elszíntelenedik. A keletkező szén-dioxidot bárium-hidroxid oldaton átengedve fehér (tejszerű) bárium-karbonát csapadék képződik.
9.2. Eljárás
9.2.1. A vizsgálandó minta egy részét kezeljük a 6.1–6.3. pontokban leírtaknak megfelelően; ez a műveletsor eltávolítja az esetleg jelenlevő detergenseket.
9.2.2. Adjunk egy spatulahegynyi (4.10.) nátrium-acetátot a 9.2.1. pontnak megfelelően kapott oldat 10 ml-éhez, és savasítsuk az oldatot néhány csepp (4.11.) jégecettel.
9.2.3. Adjunk hozzá 10%-os kalcium-klorid (4.2.) oldatot és szűrjük le. Oldjuk fel a kalcium-oxalát csapadékot 2 ml (1:1) (4.12.) kénsavban.
9.2.4. Vigyük át az oldatot egy kémcsőbe, és adjunk hozzá cseppenként körülbelül 0,5 ml 0,1 N kálium-permanganát (4.7.) oldatot. Oxalát jelenlétében az oldat színe előbb fokozatosan halványul, majd gyorsan elszíntelenedik.
9.2.5. A kálium-permanganát hozzáadását követően azonnal helyezzünk egy megfelelő méretű dugós üvegcsövet a kémcső fölé, enyhén melegítsük föl a tartalmát, és gyűjtsük össze a képződött szén-dioxidot a telített bárium-hidroxid (4.13.) oldatba. A három-öt perc után megjelenő tejszerű bárium-karbonát felhő oxálsav jelenlétére utal.
1. Cél és alkalmazási terület
Ez a módszer a fogkrém kloroformtartalmának gázkromatográfiás meghatározását írja le. A módszer legfeljebb 5% kloroformtartalom meghatározására alkalmas.
2. Fogalommeghatározás
A módszerrel meghatározott kloroformtartalmat a termék tömegszázalékban adjuk meg.
3. Alapelv
A fogkrémet olyan dimetil-formamid metanol elegyben szuszpendáljuk, amihez belső standardként ismert mennyiségű acetonitrilt adunk. Centrifugálás után a folyadékfázisból kivett mintát gázkromatografáljuk, és kiszámítjuk annak kloroformtartalmát.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. 80–100 mesh szemcseméretű Porapak Q, szirén-divinil-benzil 101 (Chromosorb) vagy ezekkel egyenértékű töltet
4.2. Acetonitril
4.3. Kloroform
4.4. Dimetil-formamid
4.5. Metanol
4.6. Belső standard oldat
Pipettázzunk 5 ml dimetil-formamidot (4.4.) egy 50 ml-es mérőlombikba, és adjunk hozzá 300 mg (M mg) pontosan mért acetonitrilt. Töltsük föl a jelig dimetil-formamiddal és keverjük össze.
4.7. A relatív válaszjel faktor meghatározására szolgáló oldat. Pipettázzunk pontosan 5 ml belső standard oldatot (4.6.) egy 10 ml-es mérőlombikba, és adjunk hozzá 300 mg (M mg) pontosan mért kloroformot. Töltsük föl a jelig dimetil-formamiddal és keverjük össze.
5. Eszközök
5.1. Analitikai mérleg
5.2. Gázkromatográf lángionizációs detektorral felszerelve
5.3. 5–10 ml-es, 0,1 ml beosztású mikrofecskendők
5.4. 1, 4 és 5 ml-es hasas pipetta
5.5. 10 és 50 ml-es mérőlombik
5.6. Körülbelül 20 ml-es, menetes kupakkal rendelkező, Sovirel France No. 20 típusú vagy ezzel egyenértékű próbacsövek.
A menetes kupak egyik oldalán teflonbevonatú belső tömítőlappal rendelkezik.
5.7. Centrifuga.
6. Eljárás
6.1. Gázkromatográfiás körülmények
6.1.1. Oszlop anyaga: üveg
Hossza: 150 cm
Belső átmérő: 4 mm
Külső átmérő: 6 mm
6.1.2. Töltsük meg a oszlopot Porapak Q, sztirén-divinil-bentén 101 (Chromosorb) vagy ezekkel egyenértékű (4.1.) 80–100 mesh szemcseméretű töltettel.
6.1.3. Lángionizációs detektor: úgy állítsuk be az érzékenységet, hogy a 4.7. pontban ismertetett oldat 3 μl-ét befecskendezve az acetonitril csúcs magassága a teljes fokbeosztásnak körülbelül háromnegyedénél legyen.
6.1.4. Gázok
Vivőgáz: nitrogén, áramlási sebesség 65 ml/perc.
Kisegítő gáz: állítsuk be a lángionizációs detektorhoz áramló gázok térfogatáramát úgy, hogy a levegő vagy oxigén térfogatárama a hidrogénének 5–10-szerese legyen.
6.1.5. Hőmérsékletek
| Injektor blokk | 210 °C | |
| Detektor blokk | 210 °C | |
| Oszlop | 175 °C |
6.1.6. Papírdiagram sebessége:
kb. 100 cm/óra
6.2. Minta-előkészítés
Olyan tubusból vegyük a vizsgálati mintát, amely még nem volt kinyitva. Nyomjuk ki a tubus tartalmának egyharmadát, ezután tegyük vissza a kupakot, gondosan keverjük össze a tubus tartalmát, majd vegyük ki a vizsgálati mintát.
6.3. Mennyiségi meghatározás
6.3.1. Egy csavaros kupakkal ellátott (5.6.) csőbe mérjünk ki 10 mg pontossággal 6–7 grammot (M0 g) a 6.2. pontnak megfelelően előkészített fogkrémből, majd adjunk hozzá három kis üveggyöngyöt.
6.3.2. Pipettázzunk pontosan 5 ml belső standard oldatot (4.6.), 4 ml dimetil-formamidot (4.4.) és 1 ml metanolt (4.5.) a kémcsőbe, zárjuk le és keverjük össze a tartalmát.
6.3.3. Mechanikus rázógépen rázassuk fél órán keresztül, majd 15 percig centrifugáljuk a lezárt csövet olyan fordulatszámon, hogy a fázisok teljesen szétváljanak.
Megjegyzés: Időnként előfordul, hogy a folyadékfázis a centrifugálást követően is zavaros. Némi javulás érhető el, ha 1–2 gramm nátrium-kloridot adunk a folyadékfázishoz, hagyjuk leülepedni, majd centrifugáljuk.
6.3.4. Fecskendezzünk 3 μl-t ebből a (6.3.3.) oldatból a 6.1. pontban leírt körülmények között. Ismételjük meg a műveletet. A fenti körülmények között tájékoztató jelleggel az alábbi retenciós idők adhatók meg:
| metanol | körülbelül egy perc | ||
| acetonitril | körülbelül 2,5 perc | ||
| kloroform | körülbelül hat perc | ||
| dimetil-formamid | > 15 perc |
6.3.5. A relatív válaszjel faktor meghatározása
Fecskendezzük be a 4.7. pont szerinti oldat 3 μl-ét a faktor meghatározása céljából. Ismételjük meg a műveletet. A relatív válaszjel faktort naponta határozzuk meg.
7. Számítások
7.1. A relatív válaszjel számítása
7.1.1. Mérjük le az acetonitril és kloroform csúcsok magasságát és a magasság felénél ezek szélességét, majd számítsuk ki a két csúcs területét a következő képlet szerint: magasság szorozva a magasság felénél mért szélességgel.
7.1.2. Határozzuk meg az acetonitril és kloroform csúcsok területét a 6.3.5. szakasznak megfelelően felvett kromatogramokon, és számítsuk ki a relatív válaszjelet, fs, a következő képlet segítségével:
| fs = | As · Mi ──── Ms · Ai | = | As · 1/10 M ───── , Ai · M1 |
ahol:
fs = a kloroform relatív válaszjel faktora;
As = a kloroform csúcs területe (6.3.5);
Ai = az acetonitril csúcs területe (6.3.5);
Ms = a kloroform mennyisége a 6.3.5. szakaszban említett 10 ml oldatban, mg-ban (= M1);
Mi = az acetonitril mennyisége a 6.3.5. szakaszban említett 10 ml oldatban, mg-ban (= 1/10 M).
Számítsuk ki a kapott értékek átlagát.
7.2. A kloroformtartalom számítása
7.2.1. A 6.3.4. szakaszban leírt eljárásban kapott kromatogramokon a 7.1.1. szakasznak megfelelően számítsuk ki a kloroform és acetonitril csúcsok területét.
7.2.2. Számítsuk ki a fogkrém kloroformtartalmát a következő képlettel:
| %X = | As · Mi ──── fs · Msx · Ai | · 100% = | As · M ─────── , fs · Ai · M0 · 100 |
ahol
%X = fogkrém kloroformtartalma tömegszázalékban kifejezve;
As = a kloroform csúcs területe (6.3.5.);
Ai = az acetonitril csúcs területe (6.3.5.);
Msx = a 6.3.1. szakaszban említett minta tömege mg-ban (1000 · M0);
Mi = az acetonitril mennyisége a 6.3.2. pontnak megfelelően kapott oldat 10 ml-ében, mg-ban (= 1/10 M).
Számítsuk ki a kapott értékek átlagát, és az eredményt adjuk meg 0,1% pontossággal.
8. Ismételhetőség *
3% (m/m) körüli kloroformtartalom esetén az azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értéke nem haladhatja meg a 0,3%-ot.
1. Cél és alkalmazási terület
Ez a módszer a cink klorid, szulfát vagy 4-hidroxi-benzol-szulfonát formájában vagy ezeknek a cinksóknak a kozmetikumokban asszociátumaként előforduló meghatározására alkalmas.
2. Fogalommeghatározás
A minta cinktartalmát bis-(2-metil-8-kinolil-oxid) só formájában gravimetrikusan határozzuk meg, és az eredményt a minta tömegére vonatkoztatva tömegszázalékban adjuk meg.
3. Alapelv
Az oldatban jelenlevő cinket savas közegben kicsapatjuk cink-bis-(2-metil-8-kinolil-oxid) formájában. Szűrés után a csapadékot szárítjuk és megmérjük.
4. Reagensek
Valamennyi reagensnek analitikai tisztaságúnak kell lennie.
4.1. 25%-os (m/m) tömény ammónia oldat;
| d | 20 ─ 4 | = 0,91 |
4.2. Jégecet
4.3. Ammónium-acetát
4.4. 2-metil-kinolin-8-ol
4.5. 6%-os (m/V) ammónia oldat
Tegyünk 240 g tömény ammónia (4.1.) oldatot egy 1000 ml-es mérőlombikba, töltsük föl a jelig desztillált vízzel és keverjük össze.
4.6. 0,2 M ammónium-acetát oldat
Oldjunk fel 15,4 g ammónium-acetátot (4.3.) desztillált vízben, töltsük jelig egy 1000 ml-es mérőlombikban és keverjük össze.
4.7. 2-metil-kinolin-8-ol oldat
Oldjunk fel 5 g 2-metil-kinolin-8-ol-t 12 ml jégecetben, és desztillált vízzel mossuk egy 100 ml-es mérőlombikba. Töltsük föl a jelig desztillált vízzel és keverjük össze.
5. Eszközök
5.1. 100 ml-es és 1000 ml-es mérőlombik
5.2. 400 ml-es főzőpohár
5.3. 50 ml-es és 150 ml-es mérőhenger
5.4. 10 ml-es mérő-pipetta
5.5. G-4 üvegszűrő tégely
5.6. 500 ml-es szívópalack
5.7. Vízsugárszivattyú
5.8. 0–100 °C közötti beosztású hőmérő
5.9. Deszikkátor megfelelő szárítószerrel és páratartalom jelzővel, pl. szilikagél vagy ezzel egyenértékű
5.10. 150 ± 2 °C-ra szabályozható hőmérsékletű szárítószekrény
5.11. pH mérő
5.12. Főzőlap.
5.13. Szűrőpapír, 4. sz. Whatman-papír vagy azzal egyenértékű
6. Eljárás
6.1. Egy 400 ml-es főzőpohárba mérjünk be 5–10 g (M gramm) vizsgálandó mintát úgy, hogy a cinktartalom 50–100 mg között legyen, adjunk hozzá 50 ml desztillált vizet és keverjük össze.
6.1.1. Szűrjük le, ha szükséges vákuum-szivattyú segítségével, és a szűrletet fogjuk fel.
6.1.2. Az extrakciós lépést még 50 ml desztillált vízzel ismételjük meg. Szűrjük le és a szűrleteket öntsük össze.
6.2. A (6.1.2.) oldatban levő cink minden 10 mg-jára számítva adjunk hozzá 2 ml 2-metil-kinolin-8-ol oldatot (4.7.) és keverjük össze.
6.3. Hígítsuk a keveréket 150 ml desztillált vízzel, melegítsük 60 °C-ig (5.12.) és folyamatos keverés közben adjunk hozzá 45 ml 0,2 M ammónium-acetát oldatot (4.6.).
6.4. A 6%-os ammóniaoldattal (4.5.) folyamatos keverés mellett állítsuk be az oldat pH-ját 5,7–5,9 közé; az oldat pH-ját a pH mérővel mérjük.
6.5. Hagyjuk az oldatot állni 30 percig. Szűrjük vízsugárszivattyú segítségével egy előzőleg kiszárított (150 °C) és lemért G4-es szűrőn, majd mossuk a csapadékot 150 ml 95 °C-os desztillált vízzel.
6.6. Helyezzük a tégelyt 150 °C-ra szabályozott hőmérsékletű szárítószekrénybe és szárítsuk egy órán át.
6.7. Vegyük ki a tégelyt a szárítószekrényből, tegyük (5.9.) exszikkátorba és amikor elérte a szobahőmérsékletet, mérjük meg a tömegét (M1 gramm).
7. Számítás
Számítsuk ki a minta százalékos (% m/m) cinktartalmát a következő képlet segítségével:
| %cink = | (M1 – M0) x 17,12 ──────── M |
ahol:
M = a 6.1. szakasznak megfelelően vett minta tömege grammban;
M0 = az üres, kiszárított szűrőtégely tömege grammban (6.5.);
M1 = a csapadékot tartalmazó szűrőtégely tömege grammban (6.7.);
8. Ismételhetőség *
1% (m/m) körüli cinktartalom esetén az azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értéke nem haladhatja meg a 0,1%-ot.
1. Cél és alkalmazási terület
A módszer 4-hidroxi-benzol-szulfonsav meghatározására és azonosítására alkalmas kozmetikai termékekben, például aeroszolokban és arcvizekben.
2. Fogalommeghatározás
Ezzel a módszerrel meghatározott 4-hidroxi-benzol-szulfonsav tartalmat vízmentes cink-4-hidroxi-benzol-szulfonát sóként fejezzük ki, és a termék tömegszázalékban adjuk meg.
3. Alapelv
A vizsgálati mintát csökkentett nyomás mellett betöményítjük, feloldjuk vízben és kloroformos extrakcióval tisztítjuk. A 4-hidroxi-benzol-szulfonsav tartalom meghatározása a szűrt vizes oldatból kivett aliquot jodometrikus titrálásával történik.
4. Reagensek
Valamennyi reagensnek analitikai tisztaságúnak kell lennie.
4.1. 36%-os (m/m) tömény sósav;
| (d | 20 ─ 4 | = 1 · 18) |
4.2. Kloroform
4.3. Bután-1-ol
4.4. Jégecet
4.5. Kálium-jodid
4.6. Kálium-bromid
4.7. Nátrium-karbonát
4.8. Szulfanilsav
4.9. Nátrium-nitrit
4.10. 0,1 N kálium-bromát
4.11. 0,1 N nátrium-tioszulfát oldat
4.12. 1% (m/V) vizes keményítő oldat
4.13. 2% (m/V) nátrium-karbonát vizes oldat
4.14. 4,5% (m/V) nátrium-nitrit vizes oldat
4.15. 0,05% (m/V) ditizon kloroformos oldata
4.16. Előhívó szer: bután-1-ol/jégecet/víz (4:1:5 térfogatarányban); választótölcsérben történő összekeverést követően távolítsuk el az alsó fázist.
4.17. Pauly reagens
Oldjunk fel 4,5 g szulfanilsavat (4.8.) 45 ml tömény sósavban (4.1.) melegítés közben, és hígítsuk az oldatot vízzel 500 ml-re. Az oldat 10 ml-ét hűtsük le jeges vízzel egy edényben, és keverés közben adjunk hozzá 10 ml hideg nátrium-nitrit oldatot (4.14.). Hagyjuk állni 15 percig 0 °C-on (e hőmérsékleten az oldat 1–3 napig eltartható) és közvetlenül a lefújása előtt (7.5.) adjunk hozzá 20 ml nátrium-karbonát (4.13.) oldatot.
4.18. Készgyártmány vékonyréteg-kromatográfiás cellulóz lapok: méret 20 x 20 cm, az adszorbens réteg vastagsága 0,25 mm.
5. Eszközök
5.1. 100 ml-es gömblombik csiszolt üvegdugóval
5.2. 100 ml-es választótölcsér
5.3. 250 ml-es Erlenmeyer-lombik csiszolt dugóval
5.4. 25 ml-es büretta
5.5. 1, 2 és 10 ml-es hasas pipetta
5.6. 5 ml-es mérőpipetta
5.7. 10 μl-es, 0,1 μl beosztású fecskendő
5.8. 0–100 °C közötti beosztású hőmérő
5.9. Fűthető vízfürdő
5.10. Jól szellőző, 80 °C-ra termosztálható szárítószekrény
5.11. Vékonyréteg-kromatográfia szokásos eszközei
6. Minta-előkészítés
A hidroxi-benzol-szulfonsav aeroszolokban történő azonosítására és mennyiségi meghatározására szolgáló, alábbiakban leírt módszerben az aeroszolos dobozból légköri nyomáson elpárolgó oldószerek és a hajtógázok felszabadulása után kapott maradékot használjuk.
7. Azonosítás
7.1. A mikrofecskendővel (5.7.) vigyünk fel 5-5 μl-t a maradékból (6) vagy a mintából a vékonyréteg-kromatográfiás lap (4.18.) alsó szélétől 1 cm távolságra levő alapvonalra, összesen hat helyre.
7.2. Helyezzük a lapot az előhívó szert tartalmazó előhívó kádba (4.16.), és addig végezzük az előhívást, amíg az oldószerfront a kiindulástól számított 15 cm távolságra nem jut.
7.3. Vegyük ki a lapot a kádból és szárítsuk 80 °C-on, amíg az ecetsav szag meg nem szűnik. Fújjuk le a lapot nátrium-karbonát (4.13.) oldattal, és levegőn szárítsuk meg.
7.4. Fedjük le a lap egyik felét egy üveglappal, és a fedetlen részt fújjuk le 0,05%-os ditizon (4.15.) oldattal. Bíborvörösbe hajló piros foltok megjelenése a kromatogramon cinkionok jelenlétére utal.
7.5. Ezt követően fedjük le a lap eddig fedetlen részét egy üveglappal és fújjuk le a másik felét a Pauly reagenssel (4.17.). A kromatogramon 0,26 Rf értéknél látható sárgásbarna foltok 4-hidroxi-benzol-szulfonsav jelenlétére, míg a 0,45 Rf értéknél látható sárga foltok 3-hidroxi-benzol-szulfonsav jelenlétére utalnak.
8. Mennyiségi meghatározás
8.1. Mérjünk be 10 g mintát vagy maradékot (6) egy 100 ml-es gömblombikba, helyezzük 40 °C-os vízfürdőbe és rotadeszten pároljuk majdnem teljesen szárazra vákuum alatt.
8.2. Pipettázzunk 10,0 ml vizet (V1) a lombikba, és melegítés közben oldjuk fel a bepárlási maradékot (8.1.).
8.3. Vigyük át az oldatot veszteség nélkül egy választótölcsérbe (5.2.) és vonjuk ki a vizes oldatot kétszer 20 ml kloroformmal (4.2.). Az kivonás után dobjuk el a kloroformos fázist.
8.4. Szűrjük le az oldatot redős szűrőn. A várt hidroxi-benzol-szulfonsav-tartalomtól függően pipettázzuk a szűrlet 1,0–2,0 ml-ét (V2) egy (5,3) 250 ml-es Erlenmeyer lombikba, majd hígítsuk 75 ml-re vízzel.
8.5. Adjunk hozzá 2,5 ml 36%-os sósavat (4.1.) és 2,5 g kálium-bromidot (4.6.) keverjük össze, és melegítsük vízfürdőn 50 °C-os hőmérsékletre az oldatot.
8.6. Egy bürettából adjunk hozzá annyi 0,1 N kálium-bromátot (4.10.), hogy a változatlanul 50 °C-os oldat színe sárgára változzon.
8.7. Adjunk hozzá még 3,0 ml kálium-bromát (4.10.) oldatot, zárjuk a lombikot a dugóval, és melegítsük további 10 percen át 50 °C-os vízfürdőn.
Amennyiben 10 perc múlva az oldat elveszíti a színét, adjunk hozzá még 2,0 ml kálium-bromát (4.10.) oldatot, zárjuk a lombikot a dugóval és melegítsük további 10 percen át 50 °C-os vízfürdőn. Jegyezzük le a hozzáadott kálium-bromát oldat összes mennyiségét (a).
8.8. Hűtsük le az oldatot szobahőmérsékletre, adjunk hozzá 2 g kálium-jodidot (4.5.) és keverjük össze.
8.9. Titráljuk a keletkező jódot 0,1 N nátrium-tioszulfát (4.11.) oldattal. A titrálás vége felé indikátorként adjunk az oldathoz néhány csepp keményítő oldatot. Jegyezzük fel a nátrium-tioszulfát oldat fogyását (b).
9. Számítás
A minta vagy a maradék (6) cink-hidroxi-benzol-szulfonsav tartalmát tömegszázalékban (% m/m) a következő képlettel számítjuk:
| cink hidroxi-benzol-szulfonát% (m/m) = | (a–b) x V1 x 0,00514 x 100 ──────────── , m x V2 |
ahol:
a = a hozzáadott 0,1 N kálium-bromát oldat összes mennyisége milliliterben (8.7.),
b = a visszatitráláshoz fogyott 0,1 N nátrium-tioszulfát oldat mennyisége milliliterben (8.9.).
m = a vizsgált termék vagy maradék mennyisége milligrammban (8.1.).
V1 = a 8.2. pontnak megfelelően kapott oldat térfogata milliliterben.
V2 = a vizsgálathoz felhasznált oldott bepárlási maradék térfogata (8.4.) milliliterben.
Megjegyzés: Aeroszolok esetében a maradék (6)%-ban (m/m) kifejezett mérési eredményét át kell számítani az eredeti termék mennyiségre. Az átszámítással kapcsolatban lásd az aeroszolok mintavételi szabályainak leírását.
10. Ismételhetőség *
5% (m/m) körüli cink-hidroxi-benzol-szulfonát-tartalom esetén az azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értékben nem haladhatja meg a 0,5%-ot.
11. Az eredmények értelmezése
A kozmetikai termékekre vonatkozó irányelv szerint a cink-4-hidroxi-benzol-szulfonát legnagyobb megengedett koncentrációja arclemosókban és dezodorokban 6% (m/m). Ez a megfogalmazás azt jelenti, hogy a hidroxi-benzol-szulfonsav-tartalom mellett a cink tartalmat is meg kell határozni. A számított cink-hidroxi-benzol-szulfonát tartalmát (9) 0,1588-kal megszorozva megkapjuk azt a minimális cinktartalmat, ami biztosan jelen van a termékben annak hidroxi-benzol-szulfonsav tartalma miatt. A gravimetrikusan meghatározott cinktartalom azonban ennél nagyobb is lehet, mert a kozmetikai termékek cink-kloridot és cink-szulfátot is tartalmazhatnak (lásd az erre vonatkozó előírásokat).
(A 80/1335/EGK első irányelv alapján)
Cél és alkalmazási terület
A hidrogén-peroxid jodometriás meghatározása kozmetikumokban csak abban az esetben végezhető el, ha azok nem tartalmaznak a jodidokat jóddá alakító más oxidálószereket. A hidrogén-peroxid jodometriás mennyiségi meghatározását ezért meg kell előznie a mintában előforduló egyéb oxidálószerek kimutatásának és azonosításának. Az azonosítás két szakaszból áll: az első a perszulfátokra, a bromátokra és a hidrogén-peroxidra, a második pedig a bárium-peroxidra vonatkozik.
1. Alapelv
A nátrium-perszulfátot, kálium-perszulfátot és ammónium-perszulfátot, valamint a kálium-bromátot, nátrium-bromátot és a hidrogén-peroxidot – függetlenül attól, hogy utóbbi bárium-peroxidból származik vagy sem – leszálló papírkromatográfiával azonosítjuk, amelynek során két előhívó oldószert használunk.
2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
2.1. A következő vegyületek 0,5%-os (m/v) vizes referenciaoldata:
2.1.1. Nátrium-perszulfát
2.1.2. Kálium-perszulfát
2.1.3. Ammónium-perszulfát
2.1.4. Kálium-bromát
2.1.5. Nátrium-bromát
2.1.6. Hidrogén-peroxid
2.2. Előhívó oldószer „A”, 80%-os (v/v) etanol
2.3. Előhívó oldószer „B”, benzol – metanol – 3-metil-bután-1-ol – víz (34:38:18:10 térfogatarányban)
2.4. Detektor A, kálium-jodid 10%-os (m/v) vizes oldata
2.5. Detektor B, keményítő 1%-os (m/v) vizes oldata
2.6. Detektor C, 10%-os sósav (m/m)
2.7. 4N sósav
3. Eszközök
3.1. Kromatográfiás papír (Whatman-papír 3. és 4. vagy ezekkel egyenértékű)
3.2. 1 μl-es mikropipetta
3.3. 100 ml-es mérőlombik
3.4. Redős szűrő
3.5. Leszálló papír-kromatográfia eszközei
4. Minta-előkészítés
4.1. Vízben oldódó termékek
Minden mintából két oldatot készítsünk 1, illetve 5 g termék 100 ml vízben történő feloldásával. Az 5. szakaszban leírt papírkromatográfia végrehajtásához az oldatok mindegyikéből 1 μl-t használjunk.
4.2. Vízben korlátozottan oldódó termékek
4.2.1. Mérjünk be külön-külön 1 g és 5 g terméket, szuszpendáljuk 50 ml vízben, egészítsük ki 100 ml-re vízzel mindkettőt és keverjük össze a mintákat. Szűrjük le a szuszpenziókat redős szűrőn (3.4.), és az 5. szakaszban leírt papírkromatográfia végrehajtásához a szűrletek mindegyikéből 1 μl-t használjunk.
4.2.2. Szuszpendáljuk újra az 1 g és 5 g terméket 50 ml vízben, savanyítsuk meg híg sósavval (2.7.), egészítsük ki vízzel 100 ml-re és keverjük össze. Szűrjük le a szuszpenziókat redős szűrőn (3.4.), és az 5. pontban leírt papírkromatográfia végrehajtásához a szűrletek mindegyikéből 1 μl-t használjunk.
4.3. Krémek
Szuszpendáljunk termékenként 5 g-ot és 20 g-ot 100 ml vízben, és ezeket a szuszpenziókat használjuk az 5. szakaszban leírt papír-kromatográfia végrehajtásához.
5. Eljárás
5.1. A leszálló papír-kromatográfia végrehajtásához tegyünk megfelelő mennyiségű A (2.2.) és B (2.3.) oldószert egy-egy kromatográfiás kádba. Legalább 24 órán át telítsük a kromatográfiás kádakat oldószergőzökkel.
5.2. Vigyünk fel 1-1 μl-t a 4. és 2.1. pontnak megfelelően előkészített minta- és referenciaoldatokból egy 40 cm hosszúságú és 20 cm szélességű vagy más megfelelő méretű kromatográfiás papírcsík (3.1.) (Whatman 3 vagy ezzel egyenértékű) kiinduló pontjaira, majd párologtassuk el az oldószert levegőn.
5.3. Helyezzük a kromatográfiás (5.2.) papírcsíkot az A előhívó oldószert (5.1.) tartalmazó kromatográfiás kádba, és addig futtatjuk, amíg az oldószerfront az alapvonaltól 35 cm-re távolodik (körülbelül 15 óra).
5.4. Ismételjük az 5.2. és 5.3. pontban leírt eljárást (Whatman 4 vagy ezzel egyenértékű) kromatográfiás papírral (3.1.) a B előhívó oldószerben. Kromatografáljuk, amíg az oldószerfront 35 cm-re távolodik az alapvonaltól (körülbelül 5 óra).
5.5. A előhívás után vegyük ki a kádból a kromatográf papírcsíkokat és szárítsuk meg levegőn.
5.6. A foltok előhívásához fújjuk le a kromatogramot sorrendben:
5.6.1. az A detektorral (2.4.), majd rövid idő múlva a B (2.5.) detektorral. Először a perszulfátok foltjai jelennek meg a kromatogramon, amelyeket a hidrogén-peroxid foltok követnek. Jelöljük meg a foltok helyét ceruzával;
5.6.2. az 5.6.1. pont szerint kapott kromatogramokat a C detektorral (2.6.); a bromátok szürkéskék folttal jelennek meg a kromatogramon.
5.7. Az A (2.2.) és B (2.3.) előhívó oldószerekre vonatkozó, fent említett körülmények között az referenciaanyagok (2.1.) Rf értékei hozzávetőlegesen a következők:
| előhívó oldószer | előhívó oldószer | ||
| A(2.2.) | B(2.3.) | ||
| Nátrium-perszulfát | 0,40 | 0,10 | |
| Kálium-perszulfát | 0,40 | 0,02 + 0,05 | |
| Ammónium-perszulfát | 0,50 | 0,10 + 0,20 | |
| Nátrium-bromát | 0,40 | 0,20 | |
| Kálium-bromát | 0,40 | 0,10 + 0,20 | |
| Hidrogén-peroxid | 0,80 | 0,80 |
1. Alapelv
A bárium-peroxidot az (A.4.2) minta savanyítása után keletkező hidrogén-peroxid segítségével és a bárium-ion jelenlétének kimutatásával azonosítjuk:
– ha (A) perszulfátok nincsenek jelen, híg kénsavnak a savas mintaoldat (B.4.1.) egy részéhez történő hozzáadása esetén fehér bárium-szulfát csapadék képződik. A bárium ion jelenlétét a (B.4.1.) mintában, ebben az esetben is papírkromatográfiával igazoljuk az alábbi 5. pontban leírt módon,
– ha a mintában egyidejűleg található bárium-peroxid és (B.4.2.) perszulfátok, a (B.4.2.) oldhatatlan maradék lúgos feltárásával és sósavban történő oldás után a bárium-ionok jelenlétét a (B.4.2.3.) olvadék oldatában papírkromatográfiával és/vagy a bárium-szulfát lecsapatásával igazoljuk.
2. Reagensek
2.1. Metanol
2.2. 36%-os (m/m) tömény sósav
2.3. 6N sósav
2.4. 4N kénsav
2.5. Rodizonsav-dinátrium só
2.6. Bárium-klorid (BaCl2 · 2H2O)
2.7. Vízmentes nátrium-karbonát
2.8. Bárium-klorid 1%-os (m/v) vizes oldata
2.9. Előhívó oldószer, amely metanolt, tömény sósavat (koncentráció 36%) és vizet tartalmaz (80:10:10 térfogatarányban)
2.10. Detektor, rodizonsav dinátrium sójának 0,1%-os (m/v) vizes oldata, amelyet felhasználás előtt frissen kell készíteni.
3. Eszközök
3.1. 5 μl-es mikropipetta
3.2. Platinatégely
3.3. 100 ml-es mérőlombik
3.4. Schleicher és Schull 2043 b vagy ezzel egyenértékű kromatográfiás papír. Helyezzük a papírt egy éjszakán keresztül a (B.2.9.) előhívó oldószert tartalmazó (A.3.5.) leszálló kromatográfiás kádba, majd szárítsuk meg.
3.5. Redős szűrő
3.5. Felszálló papírkromatográfia szokásos eszközei
4. Minta-előkészítés
4.1. Perszulfátokat nem tartalmazó termékek
4.1.1. Szuszpendáljunk 2 g terméket 50 ml vízben, és sósavval (B.2.3.) állítsuk be pH-ját 1 körüli értékre.
4.1.2. Mossuk át a szuszpenziót vízzel egy 100 ml-es mérőlombikba, töltsük fel a jelig és keverjük össze. Ezt a szuszpenziót használjuk az 5. pontban leírt papírkromatográfiás vizsgálat és a bárium-szulfát csapadék kicsapatásán alapuló azonosítás során.
4.2. Perszulfátokat tartalmazó termékek
4.2.1. Szuszpendáljunk 2 g terméket 50 ml vízben és szűrjük le.
4.2.2. Adjunk a szárított maradékhoz tömege hét-tízszeresének megfelelő mennyiségű nátrium-karbonátot (B.2.7.), keverjük össze és olvasszuk a keveréket egy platinatégelyben (B.3.2.) fél órán keresztül.
4.2.3. Hűtsük le az olvadékot szobahőmérsékletűre, oldjuk fel 50 ml vízben és szűrjük le (B.3.5.).
4.2.4. Oldjuk fel az olvadékból származó maradékot sósavban (B.2.3.), töltsük föl 100 ml-re vízzel. Ezt a szuszpenziót használjuk az 5. pontban leírt papírkromatográfiás vizsgálat és a bárium-szulfát csapadék lecsapatásán alapuló azonosítás során.
5. Eljárás
5.1. Tegyünk megfelelő mennyiségű előhívó oldószert (B.2.9.) egy felszálló papírkromatográfiás kádba és telítsük a kádat legalább 15 órán keresztül.
5.2. A B.3.4. pontban leírt módon előkészített kromatográfiás papírra három kiindulási pontban vigyünk fel 5-5 μl-t a B.4.1.2 és a B.4.2.4. pontnak megfelelően előkészített oldatokból és a B.2.8. pont szerinti referenciaoldatból.
5.3. Szárítsuk meg a minta- és referenciafoltokat levegőn. A futtatást addig folytassuk, amíg az oldószerfront a függőleges irányban 30 cm magasságig emelkedik.
5.4. Vegyük ki a kromatogramokat a kádból és szárítsuk meg levegőn.
5.5. A foltok előhívása céljából fújjuk le a papírt a B.2.10. előhívószerrel. Bárium jelenlétében, körülbelül 0,10 Rf értéknél a kromatogramon piros foltok jelennek meg.
1. Alapelv
A hidrogén-peroxid jodometriás meghatározása a következő reakción alapszik:
H2O2 + 2H+ + 2I → I2 + 2 H2O
Az átalakulás lassú folyamat, de ammónium-molibdát hozzáadásával gyorsítható. A képződő jód nátrium-tioszulfátos titrálással meghatározható, és lehetővé teszi a hidrogén-peroxid tartalom meghatározását.
2. Fogalommeghatározás
Az alábbi módon mért hidrogén-peroxid tartalmat a termék tömegére vonatkoztatva tömegszázalékban (% m/m) fejezzük ki.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. 2N kénsav
3.2. Kálium-jodid
3.3. Ammónium-molibdát
3.4. 0,1 N nátrium-tioszulfát
3.5. 10%-os (m/v) kálium-jodid oldat, közvetlenül felhasználás előtt kell készíteni
3.6. 20%-os (m/v) ammónium-molibdát oldat
3.7. 1%-os (m/v) keményítő oldat
4. Eszközök és felszerelések
4.1. 100 ml-es főzőpohár
4.2. 50 ml-es büretta
4.3. 250 ml-es mérőlombik
4.4. 25 ml-es és 100 ml-es mérőhenger
4.5. 10 ml-es egyjelű pipetta
4.6. 250 ml-es Erlenmeyer lombik
5. Eljárás
5.1. Mérjünk be 10 g (m), körülbelül 0,6 g hidrogén-peroxidot tartalmazó terméket egy 100 ml-es főzőpohárba. Egy kis vízzel mossuk a főzőpohár tartalmát egy 250 ml-es mérőlombikba, töltsük fel a jelig vízzel és keverjük össze.
5.2. Pipettázzuk az (5.1.) mintaoldat 10 ml-ét egy 250 ml-es mérőlombikba (4.6.), és adjunk hozzá 100 ml 2 N kénsavat (3.1.), 20 ml kálium-jodid (3.5.) oldatot és három csepp ammónium-molibdát (3.6.) oldatot.
5.3. Titráljuk azonnal a keletkező jódot (3.4.) 0,1 N nátrium-tioszulfát oldattal, közvetlenül a végpont előtt indikátorként adjunk hozzá néhány csepp keményítő (3.7.) oldatot. Jegyezzük fel a 0,1 N nátrium-tioszulfát (3.4.) fogyását milliliterben (V).
5.4. Az 5.2. és 5.3. szakaszokban leírt módon végezzünk vakpróba, a 10 ml mintaoldat helyett használjunk 10 ml vizet. Jegyezzük fel a 0,1 N nátrium-tioszulfát fogyását a vak meghatározásban (Vo ml).
6. Számítás
Számítsuk ki a hidrogén-peroxid tartalmat tömegszázalékban (% m/m) a következő képlet segítségével:
| | % hidrogén-peroxid = | (V–Vo) x 1,7008 x 250 x 100 ────────────── m x 10 x 1000 | = | (V–Vo) x 4,252 ─────── , m |
ahol:
m = a vizsgált termék mennyisége (5.1.),
Vo = a 0,1 N tioszulfát fogyása a vakpróbában (5.4.), milliliterben,
V = a 0,1 N tioszulfát fogyása a mintaoldat titrálása (5.3.) során, milliliterben.
7. Ismételhetőség *
A termék 6% (m/m) körüli hidrogén-peroxid tartalma esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értékben nem haladhatja meg a 0,2%-ot.
1. Cél és alkalmazási terület
Ez a módszer alkalmas a következő anyagok azonosítására és félkvantitatív meghatározására krém vagy folyadék típusú hajfestékekben:
| Anyag megnevezése | Rövidítés | |
| Fenilén-diaminok | ||
| o-Fenilén-diamin | (OPD) | |
| m-Fenilén-diamin | (MPD) | |
| p-Fenilén-diamin (V. melléklet) | (PPD) | |
| Metil-fenilén-diaminok | ||
| 4-Metil-1,2-fenilén-diamin (toluol-3,4-diamin) | (OTD) | |
| 4-Metil-1,3-fenilén-diamin (toluol-2,4-diamin) | (MTD) | |
| 2-Metil-1,4-fenilén-diamin (toluol-2,5-diamin) | (PTD) | |
| Diamino-fenolok | ||
| 2,4-diamino-fenol | (DAP) | |
| Hidrokinon | ||
| 1,4-Benzéndiol | (H) | |
| α-Naftol | (α-N) | |
| Pirogallol | ||
| 1,2,3-trihidroxi-benzol | (P) | |
| Rezorcin | ||
| 1,3-dihidroxi-benzol | (R) |
2. Alapelv
Az oxidáló színezékeket a krém vagy folyadék típusú hajfestékekből pH 10-en 96%-os etanollal kivonjuk, és egy- vagy kétdimenziós vékonyréteg-kromatográfiával azonosítjuk.
Az anyagok félkvantitatív meghatározása úgy történik, hogy a minták négy különböző előhívó rendszerben kapott kromatogramját összehasonlítjuk a hasonló körülmények között, velük egyidejűleg készített referenciaanyagok kromatogramjával.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Vízmentes etanol
3.2. Aceton
3.3. 96%-os etanol, v/v
3.4. 25%-os ammónia oldat (d420 = 0,91)
3.5. L(+)-aszkorbinsav
3.6. Kloroform
3.7. Ciklohexán
3.8. Technikai minőségű nitrogén
3.9. Toluol
3.10. Benzol
3.11. n-Butanol
3.12. Bután-2-ol
3.13. 50%-os (v/v) hipofoszforos savoldat
3.14. Diazo reagens. Vagy:
– 3-nitro-1-benzodiazónium-klórbenzol-szulfonát (stabilizált só forma), mint a Red 2 JN – Francolor, vagy azzal egyenértékű,
– 2-klór-4-nitro-1-benzodiazónium-naftalin-benzoát (stabilizált só forma), mint az NNCD reagensben – hivatkozási szám 74 150 FLUKA, vagy azzal egyenértékű.
3.15. Ezüst-nitrát
3.16. p-dimetil-amino-benzaldehid
3.17. 2,5-dimetil-fenol
3.18. Vas-klorid-hexahidrát
3.19. 10%-os (m/v) sósav oldat
3.20. Referenciaanyagok
A referenciaanyagok felsorolását az I. cím alatt a „Cél és alkalmazási terület”, tartalmazza. Amin-vegyületek esetében a referenciaanyag kizárólag hidroklorid forma (mono- vagy di-) vagy a szabad bázis.
3.21. 0,5%-os (m/v) referenciaoldatok
Készítsük el a 3.20. pontban hivatkozott referenciaanyagok 0,5%-os (m/v) oldatát. Mérjünk be 50 mg ± 1 mg referenciaanyagot egy 10 ml-es mérőlombikba.
Adjunk hozzá 5 ml 96%-os etanolt (3.3.) és 250 mg aszkorbinsavat (3.5.). Lúgosítsuk az oldatot ammónia oldat (3.4.) hozzáadásával, hogy a pH 10 körüli értéken legyen (ellenőrizzük indikátorpapírral).
Töltsük 10 ml-ig a lombikot 96%-os (3.3.) etanollal és keverjük össze.
Az oldatok fénytől védve hűvös helyen egy hétig eltarthatók.
Előfordulhat, hogy az aszkorbinsav és az ammónia hozzáadása után csapadék képződik.
Ilyenkor hagyjuk kiülepedni a csapadékot, és csak ezután folytassuk az eljárást.
3.22. Előhívó oldószerek
3.22.1. Aceton-kloroform-toluol (35:25:40 térfogatarányban)
3.22.2. Kloroform-ciklohexán-abszolút etanol-25%-os ammónia (80:10:10:1 térfogatarányban)
3.22.3. Benzol-bután-2-ol-víz (50:25:25 térfogatarányban). Rázzuk össze erőteljesen a keveréket, és szobahőmérsékleten (20–25 °C) történő elválasztás után a felső fázist használjuk.
3.22.4. n-butanol-kloroform-M reagens (7:70:23 térfogatarányban). Óvatosan válasszuk el szobahőmérsékleten (20–25 °C), és használjuk az alsó fázist.
| Az M reagens készítése | ||
| 25%-os (v/v) ammónia oldat | 24 térfogat | |
| 50%-os hipofoszforos savoldat (3.13.) | 1 térfogat | |
| Víz | 75 térfogat |
Megjegyzés:
Az ammóniát tartalmazó előhívó oldószereket közvetlenül használat előtt alaposan fel kell rázni.
3.23. Indikátor spray-k
3.23.1. Diazo reagens
Készítsük el a kiválasztott reagens (3.14.) 5%-os (m/v) vizes oldatát. Ezt az oldatot közvetlenül használat előtt kell készíteni.
3.23.2. Ehrlich reagens
Oldjunk fel 2 g (3.16) p-dimetilamino-benzaldehidet 100 ml (3.19.) sósav 10%-os (m/v) vizes oldatában.
3.23.3. 2,5-dimetil-fenol – vas-klorid-hexahidrát
1. oldat: Oldjunk fel 1 g dimetil-fenolt (3.17.) 100 ml 96%-os etanolban (3.3.).
2. oldat: Oldjunk fel 4 g vas-klorid-hexahidrátot (3.18.) 100 ml 96%-os etanolban (3.3.).
Az előhíváskor ezeket az oldatokat külön kell alkalmazni, előbb az 1. oldatot, majd a 2.-t.
3.23.4. Ammóniás ezüst-nitrát
Adjunk annyi 25%-os ammóniát (3.4.) ezüst-nitrát (3.15.) 5%-os (m/v) vizes oldatához, hogy a csapadék éppen föloldódjon. A reagenst közvetlenül felhasználás előtt kell készíteni.
Nem tárolható.
4. Eszközök
4.1. A vékonyréteg-kromatográfia szokásos laboratóriumi eszközei.
4.1.1. Műanyag vagy üveg fedél, amelynek kialakítása olyan, hogy a foltok felvitele és szárítása alatt a kromatográfiás lap környezetében nitrogén atmoszférát lehet létrehozni. Az óvintézkedésre bizonyos színezékek erős oxidációs hajlama miatt van szükség.
4.1.2. 10 μl-es, 0,2 μl-es beosztású mikrofecskendő négyzetes tűvel, vagy még jobb egy befogóállványon rögzített 50 μl-es ismétlő adagoló, amely úgy van felszerelve, hogy a lapot nitrogén alatt lehessen tartani.
4.1.3. 0,25 mm vastag, 20x20 cm-es azonnal használható szilikagél vékonyréteg lapok (műanyaghordozós Macherey and Nagel, Silica G–HR, vagy ezekkel egyenértékű)
4.2. 4000 ford/perc fordulatszámú centrifuga.
4.3. 10 ml-es, PTFE bevonatú menetes kupakkal rendelkező centrifugacsövek, vagy ezekkel egyenértékű csövek.
5. Eljárás
5.1. A vizsgálati minták kezelése
Ne használjuk a tubusból kinyomott krém első két-három cm-ét.
Mérjük be a következőket egy előzőleg nitrogénnel átöblített centrifugacsőbe (4.3.): 300 mg aszkorbinsavat, és 3 g krémet vagy 3 g homogenizált folyadékot.
Csepegtessünk 25%-os ammóniát (3.4.) az anyaghoz, amíg a pH 10-et el nem éri. Töltsük fel 10 ml-re 96%-os etanollal (3.3.).
Homogenizáljuk nitrogén (3.8.) alatt, zárjuk le, majd centrifugáljuk 4000/perc fordulatszámon 10 percig.
Használjuk a felülúszó folyadékot.
5.2. Kromatográfia
5.2.1. A minta felvitele a lapokra
Vigyünk fel a kromatográfiás lapra a fent említett referenciaoldatokból 1-1 μl-t nitrogén atmoszféra alatt (3.8.) egy egyenes mentén 9 pontban.
A referenciaoldatok foltjainak sorrendje a következő:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| R | P | H | PPD | DAP | PTD | OPD | OTD | MPD | |
| MTD | α-N |
A 10-es és 11-es pontban pedig 2 μl-t cseppentsünk az 5.1. pontban kapott mintaoldatokból.
A lapot mindaddig tartsuk nitrogén atmoszféra (3.8.) alatt, amíg a kromatográfiát el nem indítjuk.
5.2.2. Futtatás
Helyezzük a lapot előzetesen nitrogénnel (3.8.) átöblített, a négy (3.22.) oldószer egyikének gőzeivel telített kádba, szobahőmérsékleten (20–25 °C) fénytől védve futtatjuk, amíg az oldószerfront az alapvonaltól 15 cm-re távolodik.
Vegyük ki a lapot a kádból, és szárítsuk nitrogén (3.8.) alatt szobahőmérsékleten.
5.2.3. Előhívás
Azonnal fújjuk le a lapot a 3.23. pontban leírt négy előhívó egyikével.
5.2.4. Azonosítás
Hasonlítsuk össze a minta Rf értékét és színét a párhuzamosan kromatografált referencia anyagok hasonló jellemzőivel.
Az 1. táblázat példaként megadja valamennyi anyag Rf értékét és színét az összes oldószerre és indikátorra.
Ha az azonosítás eredménye nem egyértelmű, sikerre vezethet a ráméréses módszer, amikor a vizsgálati mintához hozzáadjuk a megfelelő referencia anyagot.
5.2.5. Félkvantitatív mérési módszer
Szemrevételezéssel hasonlítsuk össze az 5.2.4. pontban azonosított minden egyes anyag foltjának intenzitását és a referenciaoldatokkal a megfelelő koncentráció-tartományban felvett kromatogramok foltjainak intenzitását.
Ha a mintában előforduló egy vagy több anyag koncentrációja túlságosan nagynak mutatkozik, hígítsuk a minta kivonatot és ismételjük meg a mérést.
I. TÁBLÁZAT
A foltok Rf értéke és színe közvetlenül a permetezés után
| (3.20) | Előhívó oldószerek | Indikátor permetezők | ||||||||
| Referencia | Rf értékek | Foltok színe | ||||||||
| anyag | (3.22.1) | (3.22.2) | (3.22.3) | (3.22.4) | Diazo (3.23.1) | Ehrlich (3.23.2) | Dimetil-fenok (3.23.3) | AgNO3 (3.23.4) | ||
| OPD | 0,62 | 0,60 | 0,30 | 0,57 | világosbarna | – | – | világosbarna | ||
| MPD | 0,40 | 0,60 | 0,47 | 0,48 | ibolya-barna* | sárga | világosbarna | világosbarna | ||
| PPD | 0,20 | 0,50 | 0,30 | 0,48 | barna | élénkpiros | ibolya | szürke | ||
| OTD | 0,60 | 0,60 | 0,53 | 0,60 | barna* | halvány narancs | világosbarna | szürkésbarna | ||
| MTD | 0,40 | 0,67 | 0,45 | 0,60 | vörösesbarna* | sárga | barna | fekete | ||
| PTD | 0,33 | 0,65 | 0,37 | 0,70 | barna | narancs | ibolya* | szürke | ||
| DAP | 0,07 | – | 0 | 0,05 | barna* | narancs | ibolya | barna | ||
| H | 0,50 | 0,35 | 0,80 | 0,20 | – | narancs | ibolya | fekete* | ||
| α-N | 0,90 | 0,80 | 0,90 | 0,75 | narancsbarna | – | ibolya* | fekete | ||
| P | 0,37 | – | 0,67 | 0,05 | barna | nagyon halvány ibolya | nagyon halvány barna | barna* | ||
| R | 0,50 | 0,37 | 0,80 | 0,17 | narancs* | halvány ibolya | nagyon halvány barna | világosbarna | ||
| Megjegyzések: | ||||||||||
| 1. Az OPD csak gyengén látszik; a (3.22.3) oldószer eleggyel kell egyértelműen elválasztani az OTD-től. | ||||||||||
| 2. *A legjobban előhívható színt jelzi. | ||||||||||
6. Vizsgálat kétdimenziós vékonyréteg kromatográfiával
A kétdimenziós kromatográfiás eljárás végrehajtásához további standardok és reagensek használata szükségesek.
6.1. Kiegészítő referenciaoldatok és anyagok
6.1.1. β-naftol (β-N)
6.1.2. 2-amino-fenol (OAP)
6.1.3. 3-amino-fenol (MAP)
6.1.4. 4-amino-fenol (PAP)
6.1.5. 2-nitro-1,4-fenilén-diamin (2-NPPD)
6.1.6. 4-nitro-1,2-fenilén-diamin (4-NOPD)
Készítsük el a kiegészítő referencia anyagok 0,5%-os (m/v) oldatát a 3.21. pontban leírt módon.
6.2. Előhívó oldószer
6.2.1. Etil-acetát-ciklohexán-25%-os ammónia oldat (65:30:0,5 térfogatarányban)
6.3. Jelző rendszer
Helyezzünk egy üvegedényt egy vékonyréteg-kromatográfiás előhívó kádba, mérjünk be körülbelül 2 g kristályos jódot, és zárjuk le a kádat egy fedéllel.
6.4. Kromatográfia
6.4.1. Az 1. ábrán látható módon húzzunk két merőleges vonalat a vékonyréteg lapon (4.1.3.), az adszorbens felületén.
6.4.2. A lapot nitrogén atmoszféra (4.11.) alatt tartva vigyünk fel az 1. ábra szerinti, az 1 jelű kiindulási pontba 1–4 μl kivonatot (5.1.). A kivonat mennyisége az 5.2. szakaszban kapott kromatogramokon megjelenő foltok intenzitásától függ.
6.4.3. Osszuk el a 2 és 3 jelű pont között (1. ábra) az 5.2. szakaszban azonosított vagy az 5.2. szakasz alapján feltételezett oxidáló színezékeket (a pontok közötti távolság 1,5 cm). Vigyünk fel valamennyi referenciaoldatból 2-2 μl-t a DAP kivételével, amelyből 6 μl-t vigyünk fel a lapra. A műveletet nitrogén (6.4.2.) alatt végezzük.
6.4.4. Ismételjük meg a 6.4.3. szakaszban leírt műveletet a 4 és 5 jelű kiindulási pontokban (1. ábra) (a pontok közötti távolság 1,5 cm), és tartsuk a lapot nitrogén alatt, amíg a kromatográfia meg nem kezdődik.
6.4.5. Öblítsünk át egy kromatográfiás kádat nitrogénnel (3.8.), majd öntsünk bele megfelelő mennyiségű 3.22.2. oldószert. Tegyük a (6.4.4.) lapot a kádba, és futtassuk fénytől védve az első elúciós irányba (1. ábra). A kromatografálást addig végezzük, amíg az oldószerfront eltávolodott körülbelül 13 cm-re.
6.4.6. Vegyük ki a lapot a kádból, helyezzük egy előzetesen nitrogénnel átöblített kádba, és szárítsuk legalább 60 percen át, hogy az eluáló oldószer elpárologjon.
6.4.7. Egy térfogatmérésre alkalmas próbacsővel mérjünk be megfelelő mennyiségű eluáló oldószert (6.2.1.) egy előzetesen nitrogénnel (3.8.) átöblített kádba, tegyük be a (6.4.6.) kádba a lapot az előző helyzetéhez képest 90°-kal elforgatva, és addig végezzük a kromatografálást a másik irányban ugyancsak fénytől védve, amíg az oldószerfront el nem éri az adszorbens felületén húzott vonalat. Vegyük ki a lapot a kádból, és szárítsuk meg levegőn.
6.4.8. Tegyük be a lapot 10 percre a jódgőzökkel (6.3.) telített kromatográfiás kádba és értékeljük a kétdimenziós kromatogramot az egyidejűleg kromatografált referencia anyagok Rf, értéke és színe alapján. (A II. táblázat tájékoztató jelleggel ismerteti az Rf értékeket és a színeket).
Megjegyzés:
A foltok színének maximális intenzitása úgy biztosítható, ha a kromatogramot az előhívás után fél órán keresztül hagyjuk levegőn állni.
6.4.9. A 6.4.8. pontban azonosított oxidáló színezékek jelenléte egyértelműen igazolható, ha a 6.4.1–6.4.8. pontban írt műveletsort úgy ismételjük meg, hogy a 6.4.2. pontban az 1 jelű kiindulási pontban felvitt mennyiségen felül 1-1 μl-t felviszünk a 6.4.8.-ban azonosított színezékek referenciaoldatából is. Ha ebben a műveletsorban a 6.4.8. ponthoz képest nem jelenik meg új folt, a kromatogramnak a 6.4.8 szerinti értékelése helyes.
II. TÁBLÁZAT
Referenciaoldatok színe a kromatográfia és a jódgőzökkel történő előhívás után
| Referencia anyag | Szín, jódgőzökkel történő futtatás után | |
| R | bézs | |
| P | barna | |
| α-N | ibolya | |
| β-N | világosbarna | |
| H | ibolya-barna | |
| MPD | sárgásbarna | |
| PPD | ibolya-barna | |
| MTD | sötétbarna | |
| PTD | sárgásbarna | |
| DAP | sötétbarna | |
| OAP | narancs | |
| MAP | sárgásbarna | |
| PAP | ibolya-barna | |
| 2-NPPD | barna | |
| 4-NOPD | narancs |
1. ábra
1. Cél és alkalmazási terület
Ez a módszer a nitrit kozmetikai termékekben, különösen krémekben és pasztákban történő azonosítására alkalmas.
2. Alapelv
A nitrit jelenlétét a 2-amino-benzaldehid-fenilhidrazonnal (Nitrine R) képzett színes származékának keletkezése jelzi.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Hígított kénsav: hígítsunk 2 ml tömény kénsavat (d420 = 1,84) 11 ml desztillált vízzel.
3.2. Hígított sósav: hígítsunk 1 ml tömény sósavat (d420 = 1,19) 11 ml desztillált vízzel.
3.3. Metanol
3.4. 2-amino-benzaldehid-fenilhidrazon (Nitrine R reagens) metanolos oldata.
Mérjünk ki pontosan 2,0 g Nitrine R-t, vigyük át veszteség nélkül egy 100 ml-es mérőlombikba. Csepegtessünk hozzá 4 ml hígított sósavat (3.2.) és rázzuk össze.
Töltsük fel a jelig metanollal és addig keverjük, amíg az oldat teljesen ki nem tisztul. Az oldatot barna üvegpalackban (4.3.) tároljuk.
4. Eszközök
4.1. 50 ml-es főzőpohár
4.2. 100 ml-es mérőlombik
4.3. 125 ml-es barna üvegpalack
4.4. 10 x 10 cm-es üveglap
4.5. Műanyag spatula
4.6. 10 x 10 cm-es szűrőpapír
5. Eljárás
5.1. Egyenletesen terítsük szét a vizsgálandó minta egy részét egy üveglapon (4.4.) ügyelve arra, hogy a lap felületét legfeljebb 1 cm vastagságban borítsa be.
5.2. Itassunk át egy szűrőpapír (4.6.) lapot desztillált vízzel. Helyezzük a szűrőpapírt a mintára, és nyomkodjuk le a műanyag spatulával (4.5.).
5.3. Várjunk körülbelül egy percet, majd a szűrőpapír közepére vigyünk fel:
– két csepp hígított kénsavat (3.1.), majd
– két csepp Nitrine R (3.4.) oldatot.
5.4. Öt-tíz másodperc múlva vegyük le a szűrőpapírt, és vizsgáljuk meg fénnyel szemben tartva. A nitrit jelenlétét vöröses bíbor színeződés jelzi.
Ha a minta nitrit tartalma alacsony, a vöröses bíbor szín öt-tizenöt másodperc után sárgára változik. Nagyobb mennyiségű nitrit jelenlétében ez a színátmenet csak egy-két perc múltán megy végbe.
6. Megjegyzés
A vöröses bíbor szín intenzitásából és a sárgába történő színátmenet időtartamából a minta nitrit tartalmára lehet következtetni.
1. Cél
A módszer a nitrit kozmetikai termékekben történő mennyiségi meghatározását írja le.
2. Meghatározás
A minta nitrit tartalmát e módszerrel határozzuk meg és a nátrium-nitrit tömegszázalékában fejezzük ki.
3. Alapelv
A minta vízzel történő hígítása és derítése után a jelenlevő nitritet szulfanil-amiddal és N-1-naftil-etilén-diaminnal reagáltatjuk, és mérjük a keletkező szín optikai sűrűségét 538 nm-en.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Derítő reagensek: ezek a reagensek készítésük után legfeljebb egy hétig használhatók.
4.1.1. Carrez I reagens:
Oldjunk fel 106 g kálium-[hexaciano-ferrátot(II)], K4Fe(CN)6 · 3H2O-t desztillált vízben és hígítsuk vízzel 1000 ml-re.
4.1.2. Carrez II reagens:
Oldjunk fel 219,5 g cink-acetátot, Zn(CH3COO)2 · 2H2O-t és 30 ml jégecetet desztillált vízben és hígítsuk vízzel 1000 ml-re.
4.2. Nátrium-nitrit oldat:
Oldjunk fel 0,500 g nátrium-nitritet desztillált vízben egy 1000 ml-es mérőlombikban és vízzel töltsük fel a jelig. Az így elkészített standard törzsoldat 10,0 ml-ét hígítsuk 500 ml-re; utóbbi oldat egy ml-e 10 mikrogramm NaNO2-ot tartalmaz.
4.3. 1N nátrium-hidroxid oldat
4.4. 0,2% szulfanil-amid-hidroklorid oldat:
Oldjunk fel 2,0 g szulfanil-amidot 800 ml vízben melegítés közben. Hűtsük le, és keverés közben adjunk hozzá 100 ml tömény sósavat. Hígítsuk vízzel 1000 ml-re.
4.5. 5N sósav
4.6. N-1-naftil reagens
Ezt az oldatot a felhasználás napján kell készíteni. Oldjunk fel 0,1 g N-1-naftil-etilén-diamin-dihidrokloridot vízben és hígítsuk vízzel 100 ml-re.
5. Eszközök
5.1. Analitikai mérleg
5.2. 100, 250, 500 és 1000 ml-es mérőlombik
5.3. Hasas vagy mérőpipetta
5.4. 100 ml-es mérőhenger
5.5. 15 cm átmérőjű nitritmentes redős szűrőpapír
5.6. Vízfürdő
5.7. Spektrofotométer 1 cm-es úthosszúságú optikai cellával
5.8. pH mérő
5.9. 10 ml-es mikrobüretta
5.10. 250 ml-es főzőpohár
6. Eljárás
6.1. Mérjünk ki körülbelül 0,5 g-ot (m) 0,1 mg pontossággal a homogenizált mintából, forró desztillált vízzel veszteség nélkül mossuk át egy 250 ml-es főzőpohárba (5.10.), majd forró desztillált vízzel egészítsük ki körülbelül 150 ml-re. Tegyük a főzőpoharat (5.10.) fél órára 80 °C-os (5.6) vízfürdőbe. Közben időnként rázzuk össze a pohár tartalmát.
6.2. Hűtsük le szobahőmérsékletre, és ezután keverés közben adjunk hozzá 2 ml Carrez I (4.1.1.) reagenst és 2 ml Carrez II reagenst (4.1.2.).
6.3. 1N nátrium-hidroxiddal (4.3.) állítsuk be az anyag pH-ját 8,3-ra. Használjuk a pH mérőt (5.8.). Vigyük át veszteség nélkül egy 250 ml-es mérőlombikba (5.2.), és töltsük fel a jelig desztillált vízzel.
6.4. Keverjük össze a lombik tartalmát és redős szűrőn (5.5.) szűrjük a mintát.
6.5. A tiszta szűrletből pipettázzunk (5.3.) megfelelő mennyiséget, de legföljebb 25 ml-t egy 100 ml-es mérőlombikba (5.2.) és desztillált vízzel egészítsük ki a térfogatát 60 ml-re.
6.6. Az összekeverést követően adjunk hozzá 10,0 ml szulfanil-amid-hidroklorid oldatot (4.4.), majd 6,0 ml 5N sósavat (4.5.). Keverjük össze, és hagyjuk állni az oldatot öt percig. Adjunk hozzá 2,0 ml N-1-naftil reagenst (4.6.), keverjük össze és hagyjuk állni három percig. Hígítsuk vízzel jelig és keverjük össze.
6.7. A vakpróba készítéséhez ismételjük a 6.5. és 6.6. műveletet az N-1-naftil reagensnek az oldathoz történő hozzáadása nélkül.
6.8. Mérjük (5.7.) a 6.6. műveletben kapott oldat optikai sűrűségét 538 nm-en, referenciaként a vakoldatot (6.7.) használjunk.
6.9. A kalibrációs görbéről (6.10.) olvassuk le a minta 6.8. pontban mért optikai sűrűségnek megfelelő nátrium-nitrit tartalmat mikrogramm/100 ml koncentráció egységben (m1 mikrogramm).
6.10. Kalibrációs görbe
A 10 μg/ml koncentrációjú nátrium-nitrit (4.2.) oldat felhasználásával készítsünk 0, 20, 40, 60, 80, 100 μg nátrium-nitrát/100 ml koncentrációjú oldatokat és vegyük fel a nátrium-nitrit kalibrációs egyenesét.
7. Számítás
Számítsuk ki a minta nátrium-nitrit tartalmát tömegszázalékban a következő képlet segítségével:
| | %NaNO2 = | 250 ── V | x m1 x 10–6 x | 100 ── m | = | m1 ───── V x m x 40’ |
ahol:
m = a vizsgálatra kivett minta tömege grammban (6.1.)
m1 = a 6.9. pontban meghatározott nátrium-nitrit tartalom mikrogrammban
V = a méréshez (6.5.) felhasznált szűrlet térfogata ml-ben
8. Ismételhetőség *
0,2% (m/m) körüli nátrium-nitrit tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút értéke nem haladhatja meg a 0,005%-ot.
1. Cél és alkalmazási terület
Ez a módszer az azonosítást és a formaldehid-donorok jelenlétének, illetve távollétének megfelelően két mennyiségi meghatározást ír le. Minden kozmetikai termék esetében alkalmazható.
1.1. Azonosítás
1.2. Általános kolorimetriás meghatározás 2,4-pentándionnal
Ez a módszer akkor alkalmazható, ha a formaldehid egymagában van jelen vagy olyan más tartósítószerekkel együtt, amelyek egyike sem formaldehid-donor.
Ellenkező esetben, illetve ha az eredmény meghaladja az engedélyezett legnagyobb töménységet, a következő ellenőrzési módszert kell alkalmazni.
1.3. Mennyiségi meghatározás formaldehid-donorok jelenlétében
A fent említett módszerben (1.2.) a származékképzés során a formaldehid-donorok elhasadnak és túl magas eredményhez vezetnek (kötött és polimerizált formaldehid).
A szabad formaldehidet el kell választani folyadékkromatográfiával.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott szabad formaldehid-tartalmát tömegszázalékban fejezzük ki.
3. Azonosítás
3.1. Alapelv
A szabad és kötött formaldehid kénsavas közegben a Schiff reagenst rózsaszínűre vagy mályvaszínűre változtatja.
3.2. Reagensek
Minden reagensnek analitikai tisztaságúnak, a víznek pedig ioncseréltnek kell lennie.
3.2.1. Fukszin;
3.2.2. 7 H2O-val hidratált nátrium-szulfit;
3.2.3. Tömény sósav (d = 1,19);
3.2.4. Kénsav, kb. 1 M;
3.2.5. Schiff reagens:
Mérjünk be 100 mg fukszint (3.2.1.) egy főzőpohárba és oldjuk fel 75 ml vízben, 80 °C-on. Lehűlés után adjunk hozzá 2,5 g nátrium-szulfitot (3.2.2.). Töltsük fel 100 ml-re. Két hétig eltartható.
3.3. Eljárás
3.3.1. Mérjünk be 2 g mintát egy 10 ml-es főzőpohárba.
3.3.2. Adjunk hozzá két csepp kénsavat (3.2.4.) és 2 ml Schiff reagenst (3.2.5.). Ennek a reagensnek alkalmazáskor teljesen színtelennek kell lennie.
Rázzuk össze és hagyjuk állni öt percig.
3.3.3. Ha öt perc alatt rózsaszínű vagy mályvaszínű elszíneződés észlelhető, akkor a formaldehid 0,01%-ot meghaladó mennyiségben van jelen.
Ebben az esetben a szabad és az összetett formaldehidet a (4.) módszer, valamint szükség esetén az (5.) módszer szerint kell meghatározni.
4. Általános kolorimetriás meghatározás 2,4-pentándionnal
4.1. Alapelv
A formaldehid 2,4-pentán dionnal, ammónium-acetát jelenlétében, 3,5-diacetil-1,4-dihidro-lutidint képez. Ezt butanán-1-ollal kivonjuk és a kivonat abszorbenciáját 410 nm-en megmérjük.
4.2. Reagensek
Minden reagensnek analitikai tisztaságúnak, a víznek pedig ioncseréltnek kell lennie.
4.2.1. Vízmentes ammónium-acetát;
4.2.2. Tömény ecetsav, d420 = 1,05;
4.2.3. Alacsony nyomáson, 25 mm Hg, 25o-on frissen desztillált 2,4-pentándion – nem mutathat semennyi abszorpciót 410 nm-en.
4.2.4. Butan-1-ol;
4.2.5. Sósav, 1 M;
4.2.6. Sósav, kb. 0,1 M;
4.2.7. Nátrium-hidroxid, 1 M;
4.2.8. Frissen készített keményítő oldat, amely megfelel az Európai gyógyszerkönyv 1980-as 2. kiadása I–VII–1–1 részének (1 g/50 ml víz),
4.2.9. 37–40%-os formaldehid;
4.2.10. Jód mérőoldat, 0,05 M;
4.2.11. Nátrium-tioszulfát mérőoldat, 0,1 M;
4.2.12. 2,4-pentán-dion reagens
Oldjunk fel egy 1000 ml-es mérőlombikban:
– 150 g ammónium-acetátot (4.2.1. pont),
– 2 ml 2,4-pentán-diont (4.2.3. pont),
– 3 ml ecetsavat (4.2.2. pont).
Töltsük fel 1000 ml-re vízzel (az oldat pH-ja 6,4 körül van). Ezt a reagenst frissen kell készíteni;
4.2.13. 2,4-pentándion nélküli reagens (4.2.12. pont);
4.2.14. Standard formaldehid: törzsoldat
Öntsünk 5 g formaldehidet (4.2.9. pont) egy 1000 ml-es mérőlombikba és töltsük fel vízzel 1000 ml-re.
Állapítsuk meg az oldat erősségét a következőképpen:
Vegyünk ki 10,00 ml-t; adjunk hozzá 25,00 ml jód mérőoldatot (4.2.10. pont) és 10,00 ml nátrium-hidroxid oldatot (4.2.7. pont). Hagyjuk állni öt percig. Savanyítsuk meg 11,00 ml HCl oldattal (4.2.5. pont) és határozzuk meg a jódfelesleget nátrium-tioszulfát oldattal (4.2.11. pont) keményítő oldat (4.2.8. pont), mint indikátor jelenlétében.
1 ml 0,05 M jód (4.2.10. pont) fogyása megfelel 1,5 mg formaldehidnek;
4.2.15. Standard formaldehid: hígított oldat
Hígítsuk fel a formaldehid törzsoldatot először 1/20 majd 1/100 arányban vízzel.
Ez az oldat milliliterenként körülbelül 1 μg formaldehidet tartalmaz.
Számítsuk ki a pontos tartalmat.
4.3. Eszközök
4.3.1. Szokásos laboratóriumi felszerelés;
4.3.2. Fáziselválasztó szűrő, Whatman 1 PS (vagy ezzel egyenértékű);
4.3.3. Centrifuga
4.3.4. Vízfürdő készlet 60 °C-ra állítva;
4.3.5. Spektrofotométer;
4.3.6. Üveg küvetta, 1 cm-es optikai úthosszal.
4.4. Eljárás
4.4.1. Mintaoldat
Egy 100 ml-es mérőlombikba a vizsgálati mintából 0,001 gramm pontossággal mérjünk be kb. 150 μg formaldehid-mennyiségnek megfelelő mennyiséget (grammban). Töltsük fel 100 ml-re vízzel és keverjük össze (S oldat).
(Ellenőrizzük, hogy a pH 6-hoz közeli; ha nem, akkor hígítsuk a sósav oldattal (4.2.6. pont).) Tegyük egy 50 ml-es Erlenmeyer lombikba a következőket:
– 10,00 ml S oldat,
– 5,00 ml 2,4-pentándion reagens (4.2.12.),
– annyi ioncserélt vizet, hogy a végső térfogat 30 ml legyen.
4.4.2. Referenciaoldat
A referenciaoldat használatával a vizsgálati minta háttérszíne által okozott esetleges zavaró hatás kiküszöbölhető:
Tegyük egy 50 ml-es Erlenmeyer lombikba a következőket:
– 10,00 ml S oldat,
– 5,00 ml reagens (4.2.13.),
– annyi ioncserélt víz, hogy a végső térfogat 30 ml legyen.
4.4.3. Vakpróba
Tegyük egy 50 ml-es Erlenmeyer lombikba a következőket:
– 5,00 ml 2,4-pentán-dion reagens (4.2.12.),
– annyi ioncserélt víz, hogy a végső térfogat 30 ml legyen.
4.4.4. Mennyiségi meghatározás
4.4.4.1. A 4.4.1., 4.4.2. és a 4.4.3. pont szerinti keverékeket rázzuk össze. Állítsuk az Erlenmeyer lombikokat 60 °C-os vízfürdőbe pontosan tíz percre. Hagyjuk hűlni két percig jeges vízzel teli fürdőben.
4.4.4.2. Vigyük át egy 50 ml-es választótölcsérbe, amely 10 ml 1-butanolt (4.2.4. pont) tartalmaz. Öblítsük át mindegyik lombikot 3–5 ml vízzel. Rázzuk erősen a keveréket pontosan 30 másodpercig. Hagyjuk a fázisokat szétválni.
4.4.4.3. Szűrjük le a bután-1-olos fázist a mérőlombikba (4.3.2. pont) fáziselválasztó szűrőn keresztül. Centrifugálás (3000 g, 5 perc) is alkalmazható.
4.4.4.4. Mérjük meg a 4.4.1. pont szerinti mintaoldat kivonatának A1 abszorbanciáját 410 nm-nél a 4.4.2. pont szerinti referenciaoldat kivonatához képest.
4.4.4.5. Hasonlóképpen mérjük meg a 4.4.3. szerinti vakoldat kivonatának A2 abszorbanciáját bután-1-olhoz képest.
Megjegyzés: Az összes fenti műveletet attól a pillanattól számított 25 percen belül kell elvégezni, amikor az Erlenmeyer lombikot a 60 °C-os vízfürdőbe helyeztük.
4.4.5. Kalibrációs görbe
4.4.5.1. Tegyük egy 50 ml-es Erlenmeyer lombikba a következőket:
– 5,00 ml hígított standard oldat a 4.2.15. pont szerint,
– 5,00 ml 2,4-pentán-dion reagens (4.2.12.),
– annyi ioncserélt vizet, hogy a végső térfogat 30 ml legyen.
4.4.5.2. Folytassuk a 4.4.4. pontban leírtaknak megfelelően és mérjük meg az abszorbanciát bután-1-olhoz (4.2.4.) képest.
4.4.5.3. Ismételjük meg az eljárást 10, 15, 20 és 25 ml hígított standard oldat (4.2.15.) felhasználásával.
4.4.5.4. A nullapont meghatározásához (amely a reagensek színezettségének felel meg) járjunk el a 4.4.4.5. pontban megadottak szerint.
4.4.5.5. Szerkesszük meg a kalibrációs görbét, miután kivontuk a nullapont értékét a 4.4.5.1 és 4.4.5.3. pont szerint kapott egyes abszorbanciákból. A Beer törvény 30 μg formaldehid mennyiségig érvényes.
4.5. Számítás
4.5.1. Vonjuk ki A2-t A1-ből és olvassuk le a kalibrációs görbéről (4.4.5.5. pont) azt a μg-ban kifejezett C mennyiséget, amely a mintaoldatban jelen lévő formaldehidnek felel meg (4.4.1.).
4.5.2. Számítsuk ki a minta formaldehid tartalmát (% m/m) a következő képlet segítségével:
| | formaldehid-tartalom %-ban = | C ─── 103 · m |
ahol:
m = a vizsgálati részlet tömege a g-ban kifejezve.
4.6. Ismételhetőség *
0,2%-os formaldehid-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti eltérés nem haladhatja meg a 0,005%-ot a 2,4-pentán-dionos kolorimetriás meghatározás esetén.
Ha a szabad formaldehid-tartalom mennyiségi meghatározása a 76/768/EGK irányelvben meghatározott legnagyobb koncentrációt meghaladó eredményt ad, azaz:
a) 0,05% és 0,2% között van egy címkézetlen termékben;
b) 0,2% felett van, akár címkézett akár címkézetlen termékben,
akkor az alábbi, 5. pontban meghatározott eljárást kell alkalmazni.
5. Mennyiségi meghatározás formaldehid-donorok jelenlétében
5.1. Alapelv
A különálló formaldehidet sárga lutidin származékká alakítjuk 2,4-pentán-dionos reakció segítségével egy oszlopkimenethez illeszthető reaktorban és a keletkező származék abszorbanciáját 420 nm-en megmérjük.
5.2. Reagensek
Minden reagensnek analitikai tisztaságúnak, a víznek pedig ioncseréltnek kell lennie.
5.2.1. HPLC tisztaságú vagy azzal megegyező minőségű víz;
5.2.2. Vízmentes ammónium-acetát;
5.2.3. Tömény ecetsav;
5.2.4. 2,4-pentándion (4 °C-on tartva);
5.2.5. Vízmentes dinátrium-foszfát;
5.2.6. 85%-os ortofoszforsav (d = 1,7);
5.2.7. HPLC minőségű metanol;
5.2.8. Diklór-metán;
5.2.9. 37–40%-os (w/v) formaldehid;
5.2.10. Nátrium-hidroxid, 1 M;
5.2.11. Sósav, 1 M;
5.2.12. Sósav, 0,002 M;
5.2.13. Frissen készített keményítő oldat, amely megfelel az Európai gyógyszerkönyvnek (lásd 4.2.8. pont);
5.2.14. Jód mérőoldat, 0,05 M;
5.2.15. Nátrium-tioszulfát mérőoldat, 0,1 M;
5.2.16. Mozgó fázis:
Dinátrium-foszfát (5.2.5.) vizes oldata, 0,006 M, ortofoszforsavval (5.2.6.) pH 2,1 értékre beállított;
5.1.17. Oszlop utáni reagens:
Oldjunk fel egy 1000 ml-es mérőlombikban:
– 62,5 g ammónium-acetátot (5.2.2.),
– 7,5 ml ecetsavat (5.2.3.),
– 5 ml 2,4-pentán-diont (5.2.4.).
Töltsük fel 1000 ml-re vízzel (5.2.1.).
Ezt a reagenst tartsuk távol a fénytől.
Eltarthatóság 25 °C-on legfeljebb 3 nap.
Az oldat színe nem változhat meg;
5.2.18. Standard formaldehid: törzsoldat
Öntsünk 10 g formaldehidet (5.2.9.) egy 1000 ml-es mérőlombikba és töltsük fel 1000 ml-re vízzel.
Állapítsuk meg ennek az oldatnak az erősségét a következőképpen:
Vegyünk ki 5,00 ml-t; adjunk hozzá 25,00 ml jód mérőoldatot (5.2.14.) és 10 ml nátrium-hidroxid oldatot (5.2.10.). Hagyjuk állni öt percig. Savanyítsuk meg 11,00 ml HCl oldattal (5.2.11.) és határozzuk meg a jód mérőoldat feleslegét nátrium-tioszulfát oldattal (5.2.15.) titrálva, használjunk keményítő oldatot (5.2.13.) indikátorként. 1 ml jód oldat (5.2.14.) megfelel 1,5 mg formaldehidnek;
5.2.19. Standard formaldehid: hígított oldat
Hígítsuk fel a törzsoldatot kezdeti erősségéhez képest 1/100 arányban a mozgó fázissal.
Ennek az oldatnak 1 ml-e kb. 37 mg formaldehidet tartalmaz.
Számítsuk ki a pontos tartalmat.
5.3. Eszközök
5.3.1. Szokásos laboratóriumi felszerelés;
5.3.2. Ingadozásmentes HPLC pumpa;
5.3.3. Alacsony nyomású ingadozásmentes pumpa a reagens számára (vagy egy második HPLC pumpa);
5.3.4. Befecskendező szelep 10 μl-es hurokkal;
5.3.5. Oszlopkimenethez illeszthető reaktor a következő összetevőkkel:
– egy 1 literes háromnyakú lombik,
– egy melegítőkráter 1 literes lombikhoz,
– két Vigreux oszlop, legalább 10 lappal, kettő léghűtéses,
– 1,6 mm-es rozsdamentes acélcső (a hőcseréléshez) – belső átmérő 0,23 mm, hossz = 400 mm,
– 1,6 mm-es tefloncső – belső átmérő 0,30 mm, hossz = 5 m (csomózás) (lásd 1. függelék),
– egy T-darab, holttérfogat nélkül (Valco vagy azzal egyenértékű),
– három csatlakozó holttérfogat nélkül
Vagy: egy Applied Biosystems PCRS 520 oszlop utáni modul, vagy azzal egyenértékű, 1 ml-es reaktorral felszerelve;
5.3.6. Membránszűrő, 0,45 μm-es pórusmérettel;
5.3.7. SEP–PAKR C18 vagy azzal egyenértékű töltet;
5.3.8. Használatra kész oszlopok:
– Bischoff hypersil RP 18 (NC típus, C 25,46 1805 hivatkozás)
(5 μm, hossz = 250 mm, belső átmérő = 4,6 mm),
– vagy Doupont, Zorbax ODS
(5 μm, hossz = 250 mm, belső átmérő = 4,6 mm),
vagy Phase SEP, spherisorb ODS 2
(5 μm, hossz = 250 mm, belső átmérő = 4,6 mm).
5.3.9. Előoszlop
Bischoff K1 hypersil RP 18 (K1 G 6301 1805 hivatkozás)
(5 μm, hossz = 10 mm, vagy ezzel egyenértékű).
5.3.10. Az oszlop és az előoszlop Ecotube-rendszer segítségével van összekötve (A 15020508 Bischoff hivatkozás) vagy ezzel egyenértékű.
5.3.11. Szereljük össze a készüléket (5.3.5.) a 2. függelék diagramján bemutatottak szerint.
A befecskendező érték utáni csatlakozásokat a lehető legrövidebbre kell méretezni. Ebben az esetben a reaktor kivezetése és a detektor bevezetése közötti rozsdamentes acélcső a keverék mérés előtti hűtése céljából van elhelyezve, és a hőmérséklet a detektorban ismeretlen, de állandó;
5.3.12. UV látható detektor;
5.3.13. Adatrögzítő;
5.3.14. Centrifuga;
5.3.15. Ultrahangos fürdő;
5.3.16. Rotációs keverő (vortex vagy azzal egyenértékű)
5.4. Eljárás
5.4.1. Kalibrációs görbe
Ezt a görbét a hígított standard formaldehid oldat koncentrációjának függvényében felrajzolt csúcsmagasságok adják meg.
Készítsük el a mérőoldatokat, a standard formaldehid oldatnak (5.2.19.) a mozgó fázissal (5.2.16.) történő hígításával:
– 1,00 ml oldat (5.2.19.) hígítva 20,00 ml-re (kb. 185 μg/100 ml),
– 2,00 ml oldat (5.2.19.) hígítva 20,00 ml-re (kb. 370 μg/100 ml),
– 5,00 ml oldat (5.2.19.) hígítva 25,00 ml-re (kb. 740 μg/100 ml),
– 5,00 ml oldat (5.2.19.) hígítva 20,00 ml-re (kb. 925 μg/100 ml),
A mérőoldatokat tartsuk laboratóriumi hőmérsékleten egy órán keresztül, és frissen készítsük el.
A kalibrációs görbe linearitása az 1,00 és 15,00 μg/ml közötti koncentráció-tartományban megfelelő.
5.4.2. Minta-előkészítés
5.4.2.1. Emulziók (krémek, alapozók, szemkihúzók)
Mérjünk be egy dugóval ellátott 100 ml-es lombikba 0,001 g-os pontossággal 100 μg formaldehidnek megfelelő mennyiséget (grammban) a vizsgálati mintából. Adjunk hozzá pontosan bemért 20,00 ml diklór-metánt (5.2.8.) és 20,00 ml sósavat (5.2.12.). Keverjük össze a rotációs keverő (5.3.16.) és az ultrahangos fürdő (5.2.15.) segítségével. Válasszuk el a két fázist centrifugálással (3000 g két percig). Eközben mossuk át a töltetet (5.3.7.) 2 ml metanollal (5.2.7.), majd kondicionáljuk 5 ml vízzel (5.2.1.).
Hajtsunk át 4 ml-t a kivonat vizes fázisából a kondicionált tölteten, öntsük el az első 2 ml-t és tegyük el az azt követő részletet.
5.4.2.2. Arc- és testápolók, samponok
Mérjünk be egy dugóval ellátott 100 ml-es lombikba 0,001 g-os pontossággal egy 500 μg formaldehidnek megfelelő mennyiséget (grammban) a vizsgálati mintából.
Töltsük fel 100 ml-re a mozgó fázissal (5.2.16.).
Szűrjük le az oldatot szűrőn (5.3.6.) keresztül és fecskendezzük be vagy vezessük át egy olyan tölteten (5.3.7.), amelyet előzetesen a fenti módon (5.4.2.1.) kondicionáltunk. Minden oldatot közvetlenül az elkészítése után be kell fecskendezni.
5.4.3. Kromatográfiás körülmények
– A mozgó fázis átfolyási sebessége: 1 ml/perc,
– A reagens átfolyási sebessége: 0,5 ml/perc,
– A detektor kimenetén a teljes átfolyási sebesség: 1,5 ml/perc,
– Befecskendezett térfogat: 10 μl,
– Oldási hőmérséklet: nehéz elválasztások esetén merítsük az oszlopot olvadó jeges fürdőbe: várjuk meg amíg a hőmérséklet állandósul (15–20 perc).
– Az oszlop utáni reakció hőmérséklete: 100 °C,
– Detektálás: 420 nm-en.
Megjegyzés: A teljes kromatográfiás rendszert és az utó-oszlopot is használat után át kell mosni vízzel (5.2.1.). Ha a rendszert két napnál hosszabb ideig nem használják, akkor az átmosás után metanolos (5.2.7.) mosást is alkalmazni kell. Újrakondicionálás előtt a rendszeren vizet kell átnyomni az átkristályosodás elkerülése érdekében.
5.5. Számítás
Emulziók esetében (5.4.2.1.):
Formaldehid-tartalom%-ban (m/m,)
| | C · 10–6 · 100 ──────── 5 m | = | C · 10–4 ──── 5 m |
Arc- és testápolók, samponok esetében (5.4.2.2.):
Formaldehid-tartalom:
| | C · 10–6 · 100 ──────── m | = | C · 10–4 ──── m |
ahol:
m = a vizsgálati minta tömege g-ban (5.4.2.1.),
C = formaldehid koncentráció μg/100 ml-ben a kalibrációs görbéről leolvasva (5.4.1.).
5.6. Ismételhetőség *
0,05%-os formaldehid-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség nem haladhatja meg a 0,001%-ot.
0,2%-os formaldehid-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés nem haladhatja meg a 0,005%-ot.
Előírt tartozékok
– Egy faorsó:
külső átmérő 5 cm egy 1,5 cm átmérőjű lyukkal, amely az orsó közepén megy keresztül. Helyezzünk bele négy acélszöget (amint azt az 1. és 2. ábra mutatja). Minden két szög között a távolság 1,8 cm legyen és a szögek 0,5 cm-re legyenek a lyuktól,
– egy merev tű (horgolótű típusú) a tefloncső felcsavarására,
– 5 m hosszú 1,6 mm-es tefloncső, belső átmérő 0,3 mm.
Eljárás
A „csomózás” megindításához a tefloncsövet be kell fűzni az orsó teteje felől és ki kell vezetni alul, a középső lyukon keresztül (kb. 10 cm túlnyúlást kell hagyni a csőnek az orsó aljához képest, annak érdekében, hogy a láncot keresztül lehessen húzni csomózás közben); ezután tekerjük a csövet a négy szög köré, ahogyan a 3. ábra mutatja.
A csomózás alját és tetejét fémgyűrűkkel és szorítócsavarokkal kell megvédeni; vigyázva arra, hogy a tefloncső ne törjön el a szorosra húzás során. Tekerjük körbe a csövet még egyszer minden szög körül és készítsük el az „öltést” a következőképpen:
– emeljük az alsó csövet a felső fölé (lásd 4. ábra). Ismételjük meg ezt az eljárást minden egyes szög esetén (1, 2, 3, 4 az óramutató járásával ellentétes irányban), amíg az 5 m-t vagy a megkívánt hosszúságot el nem érjük.
Hagyjunk ki kb. 10 cm csövet a lánc lezárásához. Fűzzük át a csövet a négy hurok mindegyikén és húzzuk meg óvatosan, hogy a lánc vége összeszoruljon.
Megjegyzés: Oszlopkimenethez illeszthető reaktorok számára készített csomózás kereskedelmi forgalomban kapható (Supelco).
Az orsó sematikus rajza
1. ábra
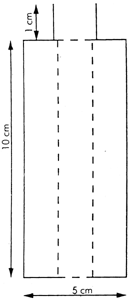
2. ábra
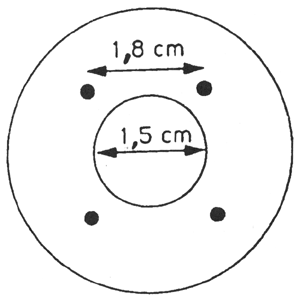
3. ábra
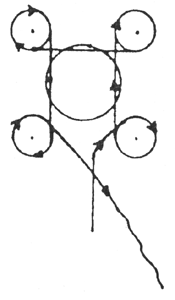
4. ábra
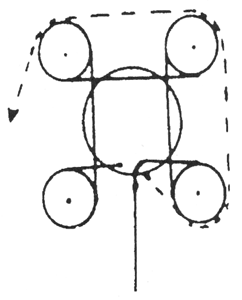
Második cső
Az „öltéshez” emeljük a kötőtűvel az alsó csövet (folyamatos vonal) a második cső fölé.
5. ábra
| 1 | = HPLC pumpa | |
| 2 | = Befecskendező szelep | |
| 3 | = Oszlop előtét oszloppal | |
| 4 | = Reagens pumpa | |
| 5 | = T-darab holttérfogat nélkül | |
| 5’ | = T-darab (Vortex) | |
| 6–6’ | = Csatlakozó holttérfogat nélkül | |
| 7 | = „Csomózás” | |
| 7’ | = Reaktor | |
| 8 | = Háromnyakú lombik forró vízzel | |
| 9 | = Melegítőkráter | |
| 10 | = Hűtő | |
| 11 | = Hőcserélő cső rozsdamentes acélból | |
| 11’ | = Hőcserélő | |
| 12 | = Látható-UV detektor | |
| 13 | = PCRS 520 oszlop utáni modul | |
| 13 | = PCRS 520 utóoszlop modul |
1. Cél és alkalmazási terület
Ez a módszer a rezorcin samponokban és hajszeszekben történő gázkromatográfiás meghatározását írja le. A módszer a minta tömegére vonatkoztatva 0,1–2,0% rezorcin meghatározására alkalmas.
2. Meghatározás
Az ezzel a módszerrel meghatározott rezorcin tartalmat a minta tömegére vonatkoztatva tömegszázalékban adjuk meg.
3. Alapelv
A rezorcint és a belső standardként adott 3,5-dihidroxi-toluolt a mintától vékonyréteg-kromatográfiával választjuk el. A két vegyületet a vékonyréteg lapról lekaparva és metanollal kivonva izoláljuk. Végül a kivont vegyületeket megszárítjuk, szililezzük és gáz-kromatografáljuk.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. 25%-os (m/m) sósav
4.2. Metanol
4.3. 96%-os (v/v) etanol
4.4. Készre gyártott szilikagél VRK lapok (műanyag vagy alumínium) fluoreszcens indikátorral. Hatástalanítsuk a következők szerint: fújjuk le a közönséges, előre bevont szilikagél lapokat vízzel, amíg fényessé nem válnak. Hagyjuk szobahőmérsékleten egy-három órán keresztül száradni.
Megjegyzés:
A lap hatástalanítása nélkül a rezorcin szilikagélen történő irreverzibilis abszorpciója miatt veszteség léphet föl.
4.5. Előhívó oldószer: aceton-kloroform-ecetsav (20:75:5 térfogatarányban).
4.6. Rezorcin standard oldat: oldjunk fel 400 mg rezorcint 100 ml 96%-os etanolban (4.3.) (1 ml 4000 μg rezorcint tartalmaz).
4.7. Belső standard oldat: oldjunk fel 400 mg 3,5-dihidroxi-toluolt (DHT) 100 ml 96%-os etanolban (4.3.) (1 ml 4000 μg DHT-t tartalmaz).
4.8. Standard elegy: elegyítsünk 10 ml (4.6.) és 10 ml (4.7.) szerinti oldatot egy 100 ml-es mérőlombikban, töltsük a jelig 96%-os etanollal (4.3.) és keverjük össze (1 ml 400 μg rezorcint és 400 μg DHT-t tartalmaz).
4.9. Szililező szerek:
4.9.1. N,O-bis-(trimetil-szilil)-trifluoro-acetamid (BSTFA)
4.9.2. Hexametil-diszilazán (HMDS)
4.9.3. Trimetil-klórszilán (TMCS)
5. Eszközök
5.1. A vékonyréteg-kromatográfia és a gázkromatográfia szokásos felszerelései
5.2. Üvegeszközök
6. Eljárás
6.1. Minta-előkészítés
6.1.1. Egy 150 ml-es főzőpohárba a termékből mérjünk be annyi vizsgálati mintát (M gramm), amely körülbelül 20–50 mg rezorcint tartalmaz.
6.1.2. Adjunk hozzá sósavat (4.1.), amíg a keverék savassá nem válik (kb. 2–4 ml szükséges) és adjunk hozzá 10 ml (40 mg DHT) belső standard oldatot (4.7.) majd keverjük össze. Etanollal (4.3.) mossuk át egy 100 ml-es mérőlombikba, töltsük fel a jelig etanollal és keverjük össze.
6.1.3. Vigyünk fel 250 μl (6.1.2) oldatot egy deaktivált szilikagél lapra (4.4.) egy 8 cm hosszú, folyamatos egyenes mentén. Ügyeljünk arra, hogy az egyenes minél vékonyabb legyen.
6.1.4. Ugyanígy vigyük fel a standard elegyből (4.8.) 250 μl-t ugyanarra a lapra (6.1.3.).
6.1.5. Az előhívást követő azonosítás egyszerűsítése céljából ugyanazon a lapon vigyünk fel párhuzamosan az alapvonalra két pontban 5-5 μl-t a 4.6. és a 4.7. oldatból.
6.1.6. Kromatografáljuk a lapot a futtatószerrel (4.5.) megtöltött telítetlen kádban, amíg az oldószerfront el nem távolodik az alapvonaltól 12 cm-re, ez általában körülbelül 45 percet vesz igénybe. Szárítsuk meg levegőn a lapot, és állapítsuk meg a rezorcin/DHT zóna helyét rövidhullámú UV fényben (254 nm). A két vegyület Rf értéke nagyjából megegyezik. A sávok sötét külső határvonalától két mm-re egy ceruzával rajzoljuk körbe a sávokat. Kaparjuk le ezeket a zónákat, és az egyes sávokat tartalmazó adszorbenst külön-külön 10 ml-es palackokban gyűjtsük.
6.1.7. Vonjuk ki a mintát és a standard elegyet tartalmazó adszorbenst a következőképpen: adjunk hozzá 2 ml metanolt (4.2.), és állandó keverés mellett egy órán keresztül vonjuk ki. Szűrjük a keveréket, majd ismételjük meg a műveletet 2 ml metanollal 15 percig extrahálva.
6.1.8. Egyesítsük a metanolos kivonatokat és megfelelő szárítószerrel töltött vákuum exszikkátorban egy éjszakán át szárítva párologtassuk el az oldószert. Semmiképpen ne melegítsük a mintákat.
6.1.9. A maradékkal végezzük el (6.1.8.) a szililezését a 6.1.9.1. vagy pedig a 6.1.9.2. alatt leírt módon.
6.1.9.1. Egy mikrofecskendővel adjunk hozzá 200 μl BSTFA-t (4.9.1.), és egy zárt edényben hagyjuk állni a keveréket 12 órán keresztül, szobahőmérsékleten.
6.1.9.2. Adjunk hozzá egymás után 200 μl HMDS-t (4.9.2.) és 100 μl TMCS-t (4.9.3.) egy mikrofecskendővel és egy zárt edényben melegítsük a keveréket 30 percen át 60 °C-on. Hűtsük le a keveréket.
6.2. Gázkromatográfia
6.2.1. Gázkromatográfiás körülmények
Az oszlop a következő megoldást eredményezi: R nem lehet kisebb, mint 1,5,
| | R = | 2d' (r2 – r1) ─────── w1 + w2 | , |
ahol:
r1 és r2= két csúcs retenciós ideje percben
w1 és w2 = ugyanezen csúcsoknak a magasság felénél mért szélessége, mm-ben
d' = a diagrampapír sebessége mm/percben
Ez a felbontás a következő beállítások mellett érhető el:
| Oszlop | anyaga: | rozsdamentes acél | ||
| hossza: | 200 cm | |||
| belső átmérője: | 3 mm | |||
| töltete: | 10% OV–17 100–120 mesh | |||
| CHROMOSORB WAW-on | ||||
| Lángionizációs detektor | ||||
| Hőmérsékletek: | ||||
| oszlop: | 185 °C (izoterm) | |||
| detektor: | 250 °C | |||
| injektor: | 250 °C | |||
| Vivőgáz: | nitrogén | |||
| térfogatáram: | 45 ml/perc | |||
A hidrogén és levegő térfogatáramának beállításával kapcsolatban kövessük a gyártó utasításait.
6.2.2. Fecskendezzünk a 6.1.9. pont szerint elkészített oldatokból 1–3 μl-t a gázkromatográfba. Minden (6.1.9.) oldatból ötször fecskendezzünk, mérjük az egy anyaghoz tartozó csúcsterületeket, átlagoljuk ezeket és számítsuk ki a csúcsterület arányt, S-t. S = rezorcin csúcsterület / DHT csúcsterület.
7. Számítás
A mintában a rezorcin koncentrációját tömegszázalékban (% m/m) a következő képlet fejezi ki:
| | rezorcin% = | 4 ─ M | x | Sminta ─────── Sstandard egyveleg | , |
ahol:
M = vizsgálati minta tömege grammban (6.1.1)
Sminta = a 6.2.2. alapján számított, a mintaoldatra vonatkozó átlag csúcsterület arány,
Sstandard elegy = a 6.2.2. alapján számított, a standard elegyre vonatkozó átlag csúcsterület arány.
8. Ismételhetőség *
0,5% körüli rezorcin tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség abszolút érték nem haladhatja meg a 0,025%-ot.
1. Cél és alkalmazási terület
Ez a módszer metanol gázkromatográfiás meghatározását írja le valamennyi kozmetikai termékfajtában (ideértve az aeroszolokat is).
A módszerrel 0–10% koncentrációk határozhatók meg.
2. Meghatározás
A módszerrel meghatározott metanol tartalmat etanolra vagy propán-2-olra vonatkoztatva tömegszázalékban adjuk meg.
3. Alapelv
A meghatározás gázkromatográfiával történik.
4. Reagensek
Használjunk analitikai minőségű reagenseket.
4.1. Metanol
4.2. Abszolút etanol
4.3. Propán-2-ol
4.4. Vízzel alkoholmentesített kloroform
5. Eszközök
5.1. Gázkromatográf:
hővezetési detektor aeroszol mintákra,
lángionizációs detektor nem aeroszol mintákra.
5.2. 100 ml-es mérőlombikok
5.3. 2 ml-es, 20 ml-es, és 0–1 ml-es tartományú pipetták
5.4. 0–100 μl-es és 0–5 μl-es mikrofecskendők és (csak aeroszol minták adagolására) különleges gázzáró fecskendő tolattyúval (lásd a mintavételi eljárásról szóló 5. ábrát * )
6. Eljárás
6.1. Minta-előkészítés
6.1.1. Az aeroszol készítményeket az 1980. december 22-i 80/1335/EGK1 bizottsági irányelv mellékletének II. fejezete alapján mintázzuk, majd gázkromatográfiásan vizsgáljuk a 6.2.1. pontban leírt körülményeknek megfelelően.
6.1.2. Az említett II. fejezetnek megfelelően mintavételezett nem aeroszol termékeket vízzel 1–2%-os etanol vagy propán-2-ol tartalomra hígítjuk, majd gázkromatográfiásan vizsgáljuk a 6.2.2 pontban leírt körülményeknek megfelelően.
6.2. Gázkromatográfia
6.2.1. Aeroszol minták esetén hővezetési detektort használunk.
6.2.1.1. Az oszlop töltete 10% Hallcomid M18, 100–200 mesh CHROMOSORB WAW hordozón.
6.2.1.2. Az oszlop a következő megoldást eredményezi: R nem lehet kisebb, mint 1,5,
| | R = | 2 | d' r2 – d' r1 ────── w1 + w2 | , |
ahol:
r1 és r2 = két csúcs retenciós ideje percben
w1 és w2 = ugyanezen csúcsoknak a magasság felénél mért szélessége, mm-ben
d' = a papírdiagram sebessége mm/percben
6.2.1.3. Ez a felbontás az alábbi beállítások mellett érhető el:
| Oszlop | anyaga: | rozsdamenetes acél | ||
| hossza: | 3,5 m | |||
| belső átmérője: | 3 mm | |||
| Hővezetési detektor híd árama: | 150 mA | |||
| vivőgáz: | Hélium | |||
| nyomás: | 2,5 bar | |||
| térfogatáram: | 45 ml/perc | |||
| Hőmérsékletek: | ||||
| injektor: | 150 °C | |||
| detektor: | 150 °C | |||
| oszlop: | 65 °C | |||
A csúcsterület mérés pontossága elektronikus integrálással javítható.
6.2.2. Nem aeroszol minták
6.2.2.1. Az oszlop Chromosorb 105 vagy Porapak QS töltetű, és a lángionizációs detektort használjuk.
6.2.2.2. Az oszlop a következő megoldást eredményezi: R nem lehet kisebb mint 1,5,
| | R = | 2 | d' r2 – d' r1 ────── w1 + w2 | , |
ahol:
r1 és r2 = két csúcs retenciós ideje percben
w1 és w2 = ugyanezen csúcsoknak a magasság felénél mért szélessége, mm-ben
d' = a papírdiagram sebessége mm/percben
6.2.2.3. Ez a felbontás az alábbi beállítások mellett érhető el:
| Oszlop | anyaga: | rozsdamentes acél | ||
| hossza | 2 m | |||
| belső átmérője: | 3 mm | |||
| Elektrométer érzékenysége: | 8 x 10–10 A | |||
| Gázok: | ||||
| vivőgáz: | Nitrogén | |||
| nyomás | 2,1 bar | |||
| térfogatáram: | 40 ml/perc | |||
| Detektor gázok | ||||
| nyomás: | 1,5 bar | |||
| térfogatáram: | 20 ml/perc | |||
| Hőmérsékletek: | ||||
| injektor | 150 °C | |||
| detektor: | 230 °C | |||
| oszlop | 120 – 130 °C | |||
7. Kalibrációs görbe
7.1. A 6.2.1. szakasz szerinti gázkromatográfiás eljárás végrehajtása (Hallcomid M18 oszlop) esetén készítsük el az alábbi táblázatban felsorolt standard elegyeket. A készítés során a komponenseket pipettával adjuk az elegyhez, de a pontos bemérést úgy határozzuk meg, hogy minden egyes hozzáadást követően lemérjük a pipettát vagy a lombikot.
| Relatív tartalom (m/m%) | Metanol (ml) | Etanol vagy propán-2-ol (ml) | Kloroformmal töltve | |
| körülbelül 2,5% | 0,5 | 20 | 100 ml-re | |
| körülbelül 5,0% | 1,0 | 20 | 100 ml-re | |
| körülbelül 7,5% | 1,5 | 20 | 100 ml-re | |
| körülbelül 10,0% | 2,0 | 20 | 100 ml-re |
Injektáljunk 2–3 μl-t a gázkromatográfra a 6.2.1. szerinti körülmények beállítása mellett. Számítsuk ki valamennyi elegyre a (metanol/etanol) vagy a (metanol/propán-2-ol) csúcsterület arányt. Ábrázoljuk a standard görbét következőket feltüntetve:
| X-tengely: | % metanol etanolra vagy propán-2-olra vonatkoztatva, | |
| Y-tengely: | (metanol/etanol) vagy (metanol/propán-2-ol) csúcsterület arány. |
7.2. A 6.2.2. pontban leírt gázkromatográfiás eljárás végrehajtása (Porapak QS vagy Chromosorb 105) esetén készítsük el az alábbi táblázatban felsorolt standard elegyeket. A készítés során a komponenseket pipettával vagy mikrofecskendővel adjuk az elegyhez, de a pontos mennyiséget minden esetben úgy határozzuk meg, hogy a hozzáadást követően lemérjük a pipettát vagy a lombikot.
| Relatív tartalom (m/m%) | Metanol (μl) | Etanol vagy propán-2-ol (ml) | Hozzáadott víz térfogata | |
| körülbelül 2,5% | 50 | 2 | 100 ml | |
| körülbelül 5,0% | 100 | 2 | 100 ml | |
| körülbelül 7,5% | 150 | 2 | 100 ml | |
| körülbelül 10,0% | 200 | 2 | 100 ml |
Injektáljunk 2–3 μl-t a gázkromatográfra a 6.2.2. pontban írt körülmények beállítása mellett.
Számítsuk ki valamennyi elegyre a (metanol/etanol) vagy a (metanol/propán-2-ol) csúcsterület arányt. Ábrázoljuk a standard görbén a következőket feltüntetve:
| X-tengely: | % metanol etanolra vagy propán-2-olra vonatkoztatva, | |
| Y-tengely: | (metanol/etanol) vagy (metanol/propán-2-ol) csúcsterület arány. |
7.3. A standard kalibrációs görbének lineárisnak kell lennie.
8. Megismételhetőség *
A termék etanolra vagy propán-2-olra vonatkoztatott 5% körüli metanol tartalma esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredményei közötti különbség nem haladhatja meg a 2,5%-ot.
(A 82/434 EGK irányelv és a módosítására kiadott 90/207/EGK irányelv alapján)
1. Cél és alkalmazási terület
Ez a módszer a diklór-metán (metilén-klorid) és az 1,1,1-triklór-etán (metil-kloroform) mennyiségi meghatározását írja le az összes olyan kozmetikai termék esetében, amely valószínűsíthetően tartalmazza ezeket az oldószereket.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott diklór-metán és 1,1,1-triklór-etán tartalmát tömegszázalékban fejezzük ki.
3. Alapelv
Gázkromatográfiás módszer kloroformos belső standard alkalmazásával.
4. Reagensek
Minden vegyszernek analitikai tisztaságúnak kell lennie.
4.1. Kloroform (CHCl3).
4.2. Szén-tetraklorid (CCl4).
4.3. Diklór-metán (CH2Cl2).
4.4. 1,1,1-triklór-etán (CH3CCl3).
4.5. Aceton.
4.6. Nitrogén.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Gázkromatográf, hővezető detektorral felszerelve.
5.3. Mintavételi palack, 50 és 100 ml közötti (lásd 5.3. mintavételi módszer) *
5.4. Fecskendő nyomás alatt lévő gázhoz, 25 vagy 50 μl-es (lásd 5.3. mintavételi módszer) *
6. Eljárás
6.1. Nem nyomás alatt lévő minta: pontosan mérjük be a mintát egy dugóval ellátott Erlenmeyer lombikba. Vezessünk bele belső standardként pontosan megmért mennyiségű, a mintában feltételezhetően megtalálható diklór-metánnal és 1,1,1-triklór-etánnal egyenértékű kloroformot (4.1.). Alaposan keverjük össze.
6.2. Nyomás alatt lévő minta: alkalmazzuk a mintavételi fejezetben megadott mintavételi módszert, de a következő finomításokkal:
6.2.1. Miután áttöltöttük a mintát egy mintagyűjtő palackba (5.3.), vezessünk bele belső standardként adott térfogatú kloroformot (4.1.), annyit, amennyi a mintában feltételezhetően megtalálható diklór-metánnal és/vagy 1,1,1-triklór-etánnal egyenértékű. Alaposan keverjük össze. Öblítsük át a szelep holttérfogatát 0,5 ml szén-tetrakloriddal (4.2.). Szárítás után a különbségből határozzuk meg pontosan a belső standard által hozzáadott tömeget.
6.2.2. Miután megtöltöttük a fecskendőt a mintával, a fecskendő szórófejét át kell fúvatni nitrogénnel (4.6.) úgy, hogy ne maradjon semmilyen maradék a kromatográfba történő fecskendezés előtt.
6.2.3. Minden egyes minta betöltése után a szelep és a csatlakozóelem felületét meg kell mosni néhányszor acetonnal (4.5.) (szükség esetén injekciós fecskendő alkalmazásával) és azután alaposan meg kell szárítani nitrogénnel (4.6.).
6.2.4. Minden elemzés esetén alkalmazzunk két különböző mintagyűjtő palackot, és minden palackkal végezzünk öt mérést.
7. Kromatográfiás körülmények
7.1. Előtétoszlop
Csövezés: rozsdamentes acél.
Hossz: 300 mm.
Átmérő: 3 vagy 6 mm.
Töltet: ugyanaz az anyag, amit az analitikai oszlop tölteténél alkalmaztak.
7.2. Oszlop
Az álló fázis sztirén-divinil-benzén (Chromosorb) hordozón Hallcomid M 18. Az oszlop „R” felbontásának 1,5 vagy annál jobbnak kell lennie:
| | R = | 2 | d' (r2 – r1) ────── W1 + W2 |
ahol:
r1 és r2 = retenciós idő (percben kifejezve),
W1 és W2 = a csúcsoknak a magasság felénél szélessége (milliméterben kifejezve),
d' = papíradagolási sebesség (milliméter/percben kifejezve).
7.3. Példaként a következő oszlopok a kívánt eredményt adják:
| Oszlop | I. | II. | |
| Alapanyag: | Rozsdamentes acél cső | Rozsdamentes acél cső | |
| Hossz: | 350 cm | 400 cm | |
| Átmérő: | 3 mm | 6 mm | |
| Hordozó: | |||
| chromosorb: | WAW | WAW-DMCS-HP | |
| szitaanalízis: | 100–120-as mesh | 60–80-as mesh | |
| Álló fázis: | Hallcomid M 18, 10% | Hallcomid M 18, 20% |
A hőmérsékleti körülmények a készülék függvényében változhatnak. A példákban a következőképpen vannak beállítva:
| Oszlop | I. | II. | |
| Hőmérsékletek: | |||
| oszlop: | 65 °C | 75 °C | |
| fecskendő: | 150 °C | 125 °C | |
| detektor: | 150 °C | 200 °C | |
| Vivőgáz: | |||
| hélium áramlási seb.: | 45 ml/perc | 60 ml/perc | |
| bemeneti nyomás: | 2,5 bar | 2 bar | |
| Befecskendezés: | 15 μl | 15 μl |
8. Az együtthatók arányossági tényezője
Készítsük el a következő, pontosan megmért keveréket egy dugóval ellátott Erlenmeyer lombikban:
Diklór-metán (4.3.), 30% (m/m).
1,1,1-triklór-etán (4.4.), 35% (m/m).
Kloroform (4.1.), 35% (m/m).
9. Számítások
9.1. A „p” anyag, „a” belső standardként választott anyaghoz viszonyított arányossági tényezőjének kiszámítása
Legyen az első anyag „p”, ahol:
| kp | = a választényezője, | |
| mp | = a tömege a keverékben, | |
| Ap | = a csúcsterülete. |
Legyen a második anyag „a”, ahol:
| ka | = a választényezője (az egységgel egyenlőnek választva), | |
| Ma | = a tömege a keverékben, | |
| Aa | = a csúcsterülete, |
akkor:
| | kp = | mp x Aa ────── Ma x Ap |
Példaként a következő választényezők kaphatók meg (kloroformra: k = 1):
| diklór-metán: | k1 = 0,78 ± 0,03 | |
| 1,1,1-triklór-etán: | k2 = 1,00 ± 0,03 |
9.2. A vizsgálati mintában lévő%-os (m/m) diklór-metán és 1,1,1-triklór-etán tartalom
Legyen:
ma = a bevezetett kloroform tömege (grammban),
Ms = az vizsgálati minta tömege (grammban),
Aa = a kloroform csúcsának területe,
A1 = a diklór-metán csúcsának területe,
A2 = az 1,1,1-triklór-metán csúcsának területe,
akkor:
| | % (m/m) CH2Cl2 = | ma x A1 x k1 x 100 ────── Aa x Ms | |
| | % (m/m) CH3CCl3 = | ma x A2 x k2 x 100 ────── Aa x Ms |
10. Ismételhetőség *
25%-os (m/m) diklór-metán és/vagy 1,1,1-triklór-etán tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 2,5%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer a 8-kinolinolnak és szulfátjának azonosítását és mennyiségi meghatározását írja le.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott 8-kinolinol és a bis(8-hidroxi-kinolin)szulfát tartalmát a 8-kinolinolra vonatkoztatott tömegszázalékban fejezzük ki.
3. Alapelv
3.1. Azonosítás
Azonosítás vékonyréteg kromatográfia alkalmazásával.
3.2. Meghatározás
A meghatározást a Fehling oldattal végbement reakció termékeként kapott komplex képződésen alapuló spektrofotometriás eljárással végezzük 410 nm-en.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. 8-kinolinol.
4.2. Benzol. Megjegyzés: Tekintettel a benzol mérgező tulajdonságára, használatakor nagy óvatossággal kell eljárni.
4.3. Kloroform.
4.4. Nátrium-hidroxid vizes oldata, 50% (m/m).
4.5. Réz-szulfát pentahidrát.
4.6. Kálium-nátrium-tartarát.
4.7. M sósav.
4.8. 0,5 M kénsav.
4.9. M nátrium-hidroxid oldat.
4.10. Etanol.
4.11. 1-butanol.
4.12. Jégecet.
4.13. 0,1 sósav.
4.14. „Celite 545” vagy annak megfelelő.
4.15. Összehasonlító oldatok
4.15.1. Mérjünk be 100 mg 8-kinolinolt (4.1.) egy 100 ml-es normál lombikba. Oldjuk fel egy kevés kénsavban (4.8.). Töltsük fel a jelig kénsavval (4.8.).
4.15.2. Mérjünk be 100 mg 8-kinolinolt (4.1.) egy 100 ml-es normál lombikba. Oldjuk fel etanolban (4.10.). Töltsük fel a jelig etanollal (4.10.) és keverjük össze.
4.16. Fehling oldat
„A” oldat
Mérjünk be 7 g réz-szulfát pentahidrátot (4.5.) egy 100 ml-es normál lombikba.
Oldjuk fel egy kevés vízben. Töltsük fel a jelig vízzel és keverjük össze.
„B” oldat
Mérjünk be 35 g kálium-nátrium-tartarátot (4.6.) egy 100 ml-es normál lombikba. Oldjuk fel 50 ml vízben. Adjunk hozzá 20 ml nátrium-hidroxidot (4.4.). Töltsük fel a jelig vízzel és keverjük össze. Közvetlenül használat előtt pipettázzunk ki 10 ml „A” oldatot és 10 ml „B” oldatot egy 100 ml-es közönséges lombikba. Töltsük fel a jelig és keverjük össze.
4.17. Eluáló szerek a vékonyréteg kromatográfiához
I: 1-butanol (4.11.)/ecetsav (4.12.)/víz (80: 20: 20; v/v/v, [térfogatarány)].
II: kloroform (4.13.)/ecetsav (4.12.) (95:5; v/v, [térfogatarány)].
4.18. 2,6-diklór-4-(klórimino)-ciklohexa-2,5-dienon, 1%-os (m/v) etanolos oldata (4.10.).
4.19. Nátrium-karbonát, 1%-os (m/v) vizes oldata.
4.20. Etanol (4.10.), 30%-os (v/v) vizes oldata.
4.21. Dinátrium-dihidrogén-etiléndiamin-tetraacetát, 5%-os (m/v) vizes oldata.
4.22. Puffer oldat, pH 7
Mérjünk be 27 g vízmentes kálium-dihidrogén-ortofoszfátot és 70 g dikálium-hidrogén-ortofoszfát trihidrátot egy 1 literes normál lombikba. Töltsük fel a jelig vízzel és keverjük össze.
4.23. Vékonyréteg lapok előkészítése
Készgyártmány, 0,25 mm vastag vékonyréteg lapok (pl. Merck Kieselgel 60 vagy annak megfelelő). Használat előtt permetezzünk rá 10 ml reagenst (4.21.) és szárítsuk meg 80 °C-on.
5. Eszközök
5.1. 100 ml-es csiszolatos gömblombik.
5.2. Normál lombikok.
5.3. Osztással ellátott pipetták, 10 és 5 ml-es.
5.4. Hasas pipetták, 20, 15, 10 és 5 ml-es.
5.5. Választótölcsérek, 100, 50 és 25 ml-es.
5.6. Redős szűrőpapír, 90 mm-es átmérőjű.
5.7. Rotációs bepárló (rotadest).
5.8. Visszafolyós hűtő csiszolt üveg nyakkal.
5.9. Spektrofotométer.
5.10. 10 mm úthosszú optikai küvetták.
5.11. Fűthető keverő.
5.12. Üveg kromatográfiás oszlop méretei: 160 mm hosszú, 8 mm átmérőjű, szűkülettel az alsó végén, amely üveggyapot dugót tartalmaz, és a felső végén egy adaptert a nyomás alá helyezés érdekében.
6. Eljárás
6.1. Azonosítás
6.1.1. Folyékony minták
6.1.1.1. A vizsgálati minta egy részének pH-ját 7,5-re állítjuk és 10 μl-t cseppentünk az előkészített szilikagél vékonyréteg lap alapvonalára (4.23.).
6.1.1.2. Az összehasonlító oldatból (4.15.2.) 10 és 30 μl-t cseppentünk az alapvonal két további pontjára, és ezután a lapot megfuttatjuk a két előhívószer (4.17.) egyikével.
6.1.1.3. Az oldószerfront 150 mm-t előrehaladása után, a lapot 110 °C-on szárítjuk (15 percen keresztül). UV lámpa alatt (366 nm) a 8-kinolinol csepp sárgán fluoreszkál.
6.1.1.4. Permetezzük le a lapot nátrium-karbonát oldattal (4.19.). Szárítsuk meg majd permetezzük le 2,6-diklór-4-(klórimino)-ciklohexa-2,5-dienon oldattal (4.18.). A 8-kinolinol kék folt formájában válik láthatóvá.
6.1.2. Szilárd minták vagy krémek
6.1.2.1. Homogenizáljunk el 1 g mintát 5 ml, 7 pH értékű puffer oldatban (4.22.). Ezután 10 ml kloroformmal (4.3.) együtt tegyük be egy rázótölcsérbe és rázzuk össze. A kloroformos réteg elválasztódása után a vizes rétegen még kétszer megismételjük a kivonást 10–10 ml kloroformmal (4.3.). Pároljuk az összeöntött és leszűrt kloroform kivonatokat majdnem szárazra egy 100 ml-es gömblombikban (5.1.) a rotációs bepárló berendezésben (5.7.). Oldjuk fel a maradékot 2 ml kloroformban (4.3.) és cseppentsünk 10 és 30 μl-t az így kapott oldatból egy szilikagél vékonyréteg lapra (4.23.) a 6.1.1.1. pontban leírtaknak megfelelően.
6.1.2.2. Tegyünk 10 és 30 μl-t a standard oldatból (4.15.2.) a lapra és folytassuk a 6.1.1.2.–6.1.1.4 pontokban leírtaknak megfelelően
6.2. Mennyiségi meghatározás
6.2.1. Folyékony minták
6.2.1.1. Tegyünk 5 g mintát egy 100 ml-es gömblombikba. Adjunk hozzá 1 ml kénsav oldatot (4.8.) és párologtassuk a keveréket alacsony nyomáson 50 °C-on majdnem szárazra.
6.2.1.2. Oldjuk fel ezt a maradékot 20 ml meleg vízben. Tegyük át egy 100 ml-es normál lombikba. Mossuk át három alkalommal 20 ml vízzel. Töltsük fel 100 ml-re vízzel és keverjük össze.
6.2.1.3. Pipettázzunk ki 5 ml-t ebből az oldatból egy 50 ml-es választótölcsérbe (5.5.). Adjunk hozzá 10 ml Fehling oldatot (4.16.). Végezzünk kivonást a kapott 8-kinolinol réz-komplexre [oxin réz (ISO)] három alkalommal 8 ml kloroform segítségével (4.3.).
6.2.1.4. Szűrjük le és gyűjtsük össze a kloroformos rétegeket egy 25 ml-es normál lombikba (5.2.). Töltsük fel a jelig kloroformmal (4.3.) és rázzuk össze. Mérjük meg a sárga oldat optikai sűrűségét kloroformmal szemben 410 nm-en.
6.2.2. Szilárd minták vagy krémek
6.2.2.1. Mérjünk be 0,500 g mintát egy 100 ml-es gömblombikba (5.1.). Adjunk hozzá 30 ml benzolt (4.2.) és 20 ml sósavat (4.7.). Forraljuk a lombik tartalmát visszafolyós hűtő alatt, keverés mellett, 30 percig.
6.2.2.2. Vigyük át a lombik tartalmát egy 100 ml-es választótölcsérbe (5.5.). Mossuk át 5 ml 1 N HCl (4.7.) segítségével. Vigyük át a vizes fázist egy gömblombikba (5.1.) és mossuk a benzolos fázist 5 ml sósavval (4.7.).
6.2.2.3. Olyan emulziók esetében, amelyek meggátolják a további kezelést keverjük össze a minta 0,500 g-ját 2 g Celite 545-tel (4.14.), hogy szabadon szóródó port kapjunk. Vigyük be a keveréket kis adagokban egy üveg kromatográfiás oszlopba (5.12.). Minden hozzáadás után nyomkodjuk le az oszlop tartalmát. Amint a keverék teljes mennyisége bekerült az oszlopba, eluáljunk sósavval, olyan módon, hogy 10 perc alatt kb. 10 ml eluált oldatot nyerjünk (szükség esetén ez az elució történhet enyhe nitrogén túlnyomás alatt). Az elució alatt biztosítani kell, hogy az oszlop töltete fölött folyamatosan legyen valamennyi sósav. Az eluált oldat első 10 ml-ét további kezelésnek vetjük alá a 6.2.2.4. pont szerint.
6.2.2.4. Párologtassuk az összegyűjtött vizes fázisokat (6.2.2.2.) vagy az eluált oldatot (6.2.2.3.) majdnem szárazra a rotációs bepárló berendezésben, csökkentett nyomáson.
6.2.2.5. Oldjuk fel a maradékot 6 ml nátrium-hidroxid oldatban (4.9.). Adjunk hozzá 20 ml Fehling oldatot (4.16.) és vigyük át a lombik tartalmát egy 50 ml-es választótölcsérbe (5.5.). Mossuk át a lombikot 8 ml kloroformmal (4.3.). Rázzuk meg és szűrjük le a kloroformos fázist egy 50 ml-es általános lombikba (5.2.).
6.2.2.6. Ismételjük meg a kivonást háromszor 8 ml kloroformmal (4.3.). Szűrjük le a kloroformos fázisokat és gyűjtsük azokat össze az 50 ml-es lombikban. Töltsük fel a jelig kloroformmal (4.3.) és rázzuk össze. Mérjük meg a sárga oldat optikai sűrűségét kloroformmal (4.3.) szemben 410 nm-en.
7. Standard görbe
3 ml 30%-os vizes etanolt (4.20.) tartalmazó négy 100 ml-es gömblombikba (5.1.) pipettázzunk 5, 10, 15 és 20 ml-es részleteket az összehasonlító oldatból (4.15.1.), amely megfelel 5, 10, 15 és 20 mg 8-kinolinolnak. Járjunk el a 6.2.1. pontban leírtak szerint.
8. Számítás
8.1. Folyékony minták
| | 8-kinolinol tartalom [tömegszázalékban (m/m)] = | a ─ m | x 100 |
ahol:
a = a 8-kinolinol milligrammjai a standard görbén (7),
m = a vizsgálati minta (6.2.1.1.) tömege (mg-ban kifejezve).
8.2. Szilárd minták vagy krémek
| | 8-kinolinol tartalom [tömegszázalékban (m/m)] = | 2a ─ m | x 100 |
ahol:
a = a 8-kinolinol milligrammjai a standard görbén (7),
m = a vizsgálati minta (6.2.2.1.) tömege (mg-ban kifejezve).
9. Ismételhetőség *
Kb. 0,3%-os 8-kinolinol tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,02%-ot.
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben lévő szabad ammónia meghatározását írja le.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott ammónia-tartalmát az ammónia tömegszázalékában fejezzük ki.
3. Alapelv
Bárium-klorid oldatot adunk a kozmetikai termék vizsgálandó részletéhez, amelyet vizes metanolos közegben hígítunk fel. Az esetlegesen képződő összes csapadékot leszűrjük vagy kicentrifugáljuk. Ezzel az eljárással elkerülhető a vízgőzdesztillálás során fellépő ammóniaveszteség egyes ammóniumsók esetében, mint pl. a karbonát és a hidrogén-karbonát, valamint a zsírsavak sói, kivéve az ammónium-acetát.
Az ammóniát vízgőzdesztillálással vonjuk ki a szűrletből vagy a felülúszóból és potenciometriás vagy más titrálással határozzuk meg.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Metanol.
4.2. Bárium-klorid dihidrát, 25%-os (m/v) oldat.
4.3. Ortobórsav, 4%-os (m/v) oldat.
4.4. Kénsav, 0,25 M mérőoldat.
4.5. Habzásgátló folyadék.
4.6. Nátrium-hidroxid, 0,5 M mérőoldat.
4.7. Indikátor, szükség esetén: keverjünk össze 5 ml 0,1% (m/v) etanolos metil-vörös oldatot 2 ml 0,1% (m/v) vizes metilén-kék oldattal.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Centrifuga lezárt 100 ml-es üvegekkel.
5.3. Vízgőzdesztilláló berendezés.
5.4. Potenciométer.
5.5. Üvegelektród és dihigany-diklorid (kalomel) viszonyító elektród.
6. Eljárás
6.1. Mérjünk be egy 100 ml-es normál lombikba 1 mg-os pontossággal legfeljebb 150 mg ammóniának felelő tömegű (m) mintát.
6.2. Adjunk hozzá 10 ml vizet, 10 ml metanolt (4.1.) és 10 ml bárium-klorid oldatot (4.2.). Töltsük fel 100 ml-re metanollal (4.1.).
6.3. Keverjük össze és tegyük éjszakára hűtőszekrénybe (5 °C).
6.4. Ezután szűrjük le vagy centrifugáljuk 10 percig zárt csövekben a még mindig hideg oldatot úgy, hogy tiszta szűrletet vagy felülúszót kapjunk.
6.5. Pipettázzunk 40 ml-t ebből a tiszta oldatból a vízgőzdesztilláló felszerelésbe (5.3.), tegyünk hozzá 0,5 ml habzásgátló folyadékot (4.5.), ha szükséges.
6.6. Desztilláljuk és gyűjtsünk 200 ml desztillátumot egy 250 ml-es főzőpohárba, amely 10 ml kénsavas mérőoldatot (4.4.) és 0,1 ml indikátort (4.7.) tartalmaz.
6.7. Titráljuk vissza a felesleges savat nátrium-hidroxid mérőoldattal (4.6.).
6.8. Megjegyzés: Potenciometriás meghatározáshoz gyűjtsünk össze 200 ml desztillátumot egy 250 ml-es főzőpohárba, amely 25 ml ortobórsav oldatot (4.3.) tartalmaz és titráljunk kénsavmérővel (4.4.), miközben felvesszük a semlegesítési görbét.
7. Számítások
7.1. Számítás visszatitrálás esetén
Legyen:
V1 = a felhasznált nátrium-hidroxid oldat (4.6.) térfogata (milliliterben),
T1 = az aktuális molaritása (4.6.),
T2 = a kénsav oldat (4.4.) aktuális molaritási tényezője,
m = a kivett vizsgálati minta (6.1.) tömege (milligrammban),
ekkor:
| | ammónia% (m/m) = | (10T2 – V1T1) x 17 x 100 ──────────── 0,4 m | = | (20T2 – V1T1) x 4250 ────────── m |
7.2. Számítás közvetlen potenciometriás titrálás esetén
Legyen:
V2 = a felhasznált kénsav oldat (4.4.) térfogata (milliliterben),
T2 = az aktuális molaritása (4.4.),
m = a kivett vizsgálati minta (6.1.) tömege (milligrammban),
ekkor:
| | ammónia% (m/m) = | (V2 – T2) x 17 x 100 ────────── 0,4 m | = | 4250V2T2 ──── m |
8. Ismételhetőség *
Kb. 6%-os ammónia tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,6%-ot.
1. Cél és alkalmazási terület
Ez a módszer legfeljebb kb. 0,3% nitro-metán tartalom esetén alkalmas az azonosításra és a meghatározásra, olyan kozmetikai termékek esetében, amelyek aeroszolos flakonba vannak csomagolva.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott nitro-metán tartalmát a nitro-metán tömegszázalékában fejezzük ki az aeroszolos flakon teljes tartalmához képest.
3. Alapelv
A nitro-metánt színreakcióval azonosítjuk. A nitro-metánt gázkromatográfiával határozzuk meg belső mérőoldat hozzáadása után.
4. Azonosítás
4.1. Reagensek
Minden vegyszernek analitikai tisztaságúnak kell lennie.
4.1.1. Nátrium-hidroxid, 0,5 M oldat.
4.1.2. Folin reagens
Oldjunk fel 0,1 g nátrium-3,4-dihidro-3,4-dioxonaftalin-1-szulfonátot vízben, és hígítsuk fel 100 ml-re.
4.2. Eljárás
A minta 1 ml-éhez adjunk 10 ml 4.1.1 és 1 ml 4.1.2. pontban szereplő anyagot. Lila elszíneződés jelzi a nitro-metán jelenlétét.
5. Meghatározás
5.1. Reagensek
Minden vegyszernek analitikai tisztaságúnak kell lennie.
5.1.1. Kloroform (belső standard 1).
5.1.2. 2,4-dimetil-heptán (belső standard 2).
5.1.3. Etanol, 95%.
5.1.4. Nitro-metán.
5.15. Kloroform mérőoldat
Egy mérlegelt 25 ml-es mérőlombikba tegyünk kb. 650 mg kloroformot (5.1.1.). Pontosan mérjük le ismét a lombikot és a tartalmát. Töltsük fel 25 ml-re 95%-os etanollal (5.1.3.). Mérjük le és számítsuk ki ennek az oldatnak a tömegszázalékos kloroform tartalmát.
5.1.6. 2,4-dimetil-heptán mérőoldat
Hasonlóan készítsük el, mint a kloroform összehasonlító oldatot, de 270 mg 2,4-dimetil-heptánt (5.1.2.) mérjünk be a 25 ml-es mérőlombikba.
5.2. Eszközök
5.2.1. Gázkromatográf, lángionizáció mérésére alkalmas detektorral.
5.2.2. Aeroszol minták vételezésére alkalmas eszközök (mintavételi palack, mikrofecskendő, csatlakozó stb.), amint azt a 1980. december 22-i 80/1335/EGK bizottsági irányelv * a mellékletének II. fejezete részletesen leírja.
5.2.3. Szokásos laboratóriumi felszerelés.
5.3. Eljárás
5.3.1. A minta előkészítése
Egy lemért 100 ml-es mintavételi palackba, amelyet a fent említett irányelv II. fejezetének 5.4. pontjában leírt eljárásnak megfelelően gázmentesítettük vagy kiszívattunk, tegyünk kb. 5 ml-t valamelyik belső standardból (5.1.5. vagy 5.1.6.). Használjunk 10 vagy 20 ml-es üvegfecskendőt, tű nélkül, amely megfelel a csatlakozóelemnek a Bizottság fent említett irányelve II. fejezetének (5) bekezdésében leírt technikának. Ugyanezzel a technikával vigyünk be a palackba kb. 50 g mintát az aeroszolos flakon tartalmából. Mérjük le ismét a tömegét a bevitt minta mennyiségének meghatározásához. Keverjük jól össze.
Fecskendezzünk be 10 μl-t a megadott mikrofecskendő (5.2.2.) alkalmazásával. Végezzünk öt befecskendezést.
5.3.2. A mérőoldat előkészítése
Pontosan mérjünk be kb. 500 mg nitro-metánt (5.1.4.) és vagy 500 mg kloroformot (5.1.1.) vagy 210 mg 2,4-dimetil-heptánt (5.1.2.) egy 50 ml-es mérőlombikba.
Töltsük fel a jelig 95%-os etanollal (5.1.3.). Keverjük jól össze. Tegyünk 5 ml-t ebből az oldatból egy 20 ml-es mérőlombikba. Töltsük fel a jelig 95%-os etanollal (5.1.3.). Fecskendezzünk be 10 μl-t a megadott mikrofecskendő (5.2.2.) alkalmazásával. Végezzünk öt befecskendezést.
5.3.3. Gázkromatográfiás körülmények
5.3.3.1. Oszlop
Az oszlop két részből áll, az első didecil-ftalátot tartalmaz Gas Chrom Q tölteten, a második Ucon 50 HB 280 X-et Gas Chrom Q tölteten. Az így elkészített összetett oszlop felbontásának eredménye „R” 1,5 vagy annál jobbnak kell lennie:
| | R = 2 | d’ (r2 –r1) ────── W1 + W2 |
legyen:
r1 és r2 = retenciós idő (percben),
W1 és W2 = a csúcsoknak a magasság felénél mért szélessége (milliméterben),
d’ = a papíradagolás sebessége (milliméter/percben).
Példaként a következő két rész a kívánt eredményt hozza:
„A” oszlop
Alapanyag: rozsdamentes acél
Hossz: 1,5 m
Átmérő: 3 mm
Töltet: 20% didecil-ftalát, Gas Chrom Q-n (100–120 mesh).
„B” oszlop
Alapanyag: rozsdamentes acél
Hossz: 1,5 m
Átmérő: 3 mm
Töltet: 20% Ucon 50 HB 280X, Gas Chrom Q-n (100–120 szemcseméret).
5.3.3.2. Detektor:
A megfelelő érzékenységű beállítás a lángionizációs detektor elektrométere számára 8x10–10 A.
5.3.3.3. Hőmérsékleti körülmények
A következő értékek bizonyultak alkalmasnak:
Befecskendezés: 150 °C,
Detektor: 150 °C,
Oszlop: 50 °C és 80 °C között az egyes oszlopok és eszközök típusától függően.
5.3.3.4. Alkalmas gázellátás
Vivőgáz: nitrogén.
Nyomás: 2,1 bar.
Áramlási sebesség: 40 ml/perc.
Detektor ellátás: a detektor gyártójának meghatározása szerint.
6. Számítások
6.1. A nitro-metán arányossági tényezőjének kiszámítása az alkalmazott belső standardhoz viszonyítva
Ha „n” jelenti a nitro-metánt:
legyen:
kn = a választényezője,
m’n = a tömege (grammban) a keverékben,
S’n = a csúcsterülete.
Ha „c” jelenti a belső standardot, a kloroformot vagy a 2,4-dimetil-heptánt:
legyen:
m’c = a tömege (grammban) a keverékben,
S’c = a csúcsterülete,
akkor:
| | kn = | m’n ─── m’c | x | S’c ─── S’n |
(kn a felszerelés függvénye).
6.2. A mintában lévő nitro-metán koncentrációja
Ha „n” jelenti a nitro-metánt:
Legyen:
kn = a arányossági tényező,
Sn = a csúcsterülete,
Ha „c” jelenti a belső standardot, a kloroformot vagy a 2,4-dimetil-heptánt:
Legyen:
mc = a tömege (grammban) a keverékben,
Sc = a csúcsterülete,
M = a bevitt aeroszol tömege (grammban),
akkor a nitro-metán%-os (m/m) aránya a mintában:
| | mc ─── M | x | kn x Sn ─── Sc | x 100 |
7. Ismételhetőség *
Kb. 0,3%-os (m/m) nitro-metán tartalom esetén azonos mintán párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,03%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer a tioglikolsav (merkapto-ecetsav) azonosítását és mennyiségi meghatározását írja le hajhullámosító, hajkiegyenesítő- és szőrtelenítő szerekben, amelyekben más redukáló szerek is jelen lehetnek.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott tioglikolsav tartalmát a tioglikolsav tömegszázalékában fejezzük ki.
3. Alapelv
A tioglikolsavat színreakcióval és vékonyréteg kromatográfiával azonosítjuk, és mennyiségét jodometriásan vagy gázkromatográfiával határozzuk meg.
4. Azonosítás
4.1. Azonosítás színreakcióval
4.1.1. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1.1.1. Ólom-di(acetát) papír.
4.1.1.2. Sósav oldat (egy térfogat tömény sósav és egy térfogat víz).
4.1.2. Eljárás
4.1.2.1. Tioglikolsav azonosítása az ólom-di(acetáttal) létrejövő színreakció segítségével
Helyezzük a vizsgálati minta egy cseppjét ólom-di(acetát) papírra (4.1.1.1.). Ha élénk sárga szín jelenik meg, akkor valószínű a tioglikolsav jelenléte.
Érzékenység 0,5%.
4.1.2.2. A szervetlen szulfidok jellemzése savanyításra keletkező hidrogén-szulfid képződése alapján
Helyezzük a minta néhány milligrammját egy vizsgálati kémcsőbe. Adjunk hozzá 2 ml desztillált vizet és 1 ml sósavat (4.1.1.2.). Hidrogén-szulfid fejlődik, amit jellegzetes szaga alapján észlelni lehet, és fekete ólom-szulfid csapadék válik ki az ólom-di(acetát) papíron (4.1.1.1.).
Érzékenység 50 ppm.
4.1.2.3. A szulfitok jellemzése savanyításra keletkező kén-dioxid képződése alapján
Járjunk el a 4.1.2.2. pontban leírtak szerint. Forraljuk fel. A fejlődő kén-dioxidot a szaga és a pl. permanganát ionokon megfigyelhető redukáló tulajdonsága alapján észlelni lehet.
4.2. Azonosítás vékonyréteg kromatográfiával
4.2.1. Reagensek
Minden reagensek analitikai tisztaságúnak kell lennie, kivéve, ha egyéb előírás van feltüntetve.
4.2.1.1. Tioglikolsav, legalább 98%-os tisztaságú, jodometriával megvizsgálva.
4.2.1.2. 2,2’-ditio-di(ecetsav), legalább 99%-os tisztaságú, jodometriával megvizsgálva.
4.2.1.3. Tiolaktánsav, legalább 95%-os tisztaságú, jodometriával megvizsgálva.
4.2.1.4. 3-merkapto-propánsav, legalább 98%-os tisztaságú, jodometriával megvizsgálva.
4.2.1.5. 1-tioglicerin, legalább 98%-os tisztaságú, jodometriával megvizsgálva.
4.2.1.6. Vékonyréteg lapok, szilikagél, készgyártmány kiszerelésben, 0,25 mm vastag.
4.2.1.7. Vékonyréteg lapok, alumínium-oxid, Merck F 254 E vagy ezzel azonos.
4.2.1.8. Sósav, tömény d420 = 1,19 g/ml.
4.2.1.9. Etil-acetát.
4.2.1.10. Kloroform.
4.2.1.11. Diizopropil-éter.
4.2.1.12. Szén-tetraklorid.
4.2.1.13. Jégecet.
4.2.1.14. Kálium-jodid, 1%-os (m/v) vizes oldat.
4.2.1.15. Platina-tetraklorid, 0,1%-os (m/v), vizes oldat.
4.2.1.16. Oldószerek
4.2.1.16.1. Etil-acetát (4.2.1.9.), kloroform (4.2.1.10.), diizopropil-éter (4.2.1.11.), ecetsav (4.2.1.13.) (20:20:10:10, térfogatarányban).
4.2.1.16.2. Kloroform (4.2.1.10.), ecetsav (4.2.1.13.) (90:20, térfogatarányban).
4.2.1.17. Detektálószer
4.2.1.17.1. Használat előtt közvetlenül keverjünk össze egyenlő térfogatokat a (4.2.1.14.) és a (4.2.1.15.) oldatból.
4.2.1.17.2. Bróm oldat, 5% (m/v):
Oldjunk fel 5 g brómot 100 ml szén-tetrakloridban (4.2.1.12.).
4.2.1.17.3. Fluoreszcein oldat, 0,1% (m/v):
Oldjunk fel 100 mg fluoreszceint 100 ml 95%-os etanolban.
4.2.1.17.4. Hexaammónium-heptamolibdát, 10%-os (m/v), vízben feloldva.
4.2.1.18. Összehasonlító oldatok
4.2.1.18.1. Tioglikolsav (4.2.1.1.), 0,4%-os (m/v) vizes oldata.
4.2.1.18.2. 2,2’-ditio-di(ecet)sav (4.2.1.2.), 0,4%-os (m/v) vizes oldata.
4.2.1.18.3. 2-merkapto-propánsav (4.2.1.3.), 0,4%-os (m/v) vizes oldata.
4.2.1.18.4. 3-merkapto-propánsav (4.2.1.4.), 0,4%-os (m/v) vizes oldata.
4.2.1.18.5. 3-merkapto-1,2-propándiol (4.2.1.5.), 0,4%-os (m/v) vizes oldata.
4.2.2. Eszközök
Szokásos laboratóriumi felszerelés vékonyréteg kromatográfiához.
4.2.3. Eljárás
4.2.3.1. A vizsgálati minták kezelése
Savasítsuk meg a vizsgálati mintát pH 1-re néhány csepp sósavval (4.2.1.8.) és szűrjük le, ha szükséges.
Egyes esetekben érdemes lehet a mintát felhígítani. Ha így járunk el, a sósavas savasítást a hígítás előtt végezzük el.
4.2.3.2. Kioldás
Helyezzünk a lapra 1 μl mintaoldatot (4.2.3.1.) és egy-egy ml-t mind az öt összehasonlító oldatból (4.2.1.18.). Szárítsuk meg óvatosan gyenge nitrogénáram alatt és oldjuk ki a lapot a 4.2.1.16.1 vagy a 4.2.1.16.2. pontban felsorolt oldattal. Szárítsuk meg a lapokat amilyen gyorsan csak lehet, a tiolok oxidálódásának lehető legkisebbre való csökkentése érdekében.
4.2.3.3. Detektálás
Permetezzük be a lapot a három reagens egyikével (4.2.1.17.1., 4.2.1.17.3. vagy 4.2.1.17.4.). Ha a lapot a (4.2.1.17.3.) reagenssel permeteztük be, akkor kezeljük azt tovább telített brómgőzzel, amíg a foltok láthatóvá nem válnak. A (4.2.1.17.4.) permetező-reagenssel való detektálás csak akkor lehet kielégítő, ha a vékonyréteg szárításának időtartama nem haladta meg a 30 percet.
4.2.3.4. Kiértékelés
Hasonlítsuk össze az Rf értékeket és az összehasonlító oldatok színét a standardokéval. Az alább megadott átlagos Rf értékek csupán támpontként szolgálnak az összehasonlításhoz. Azok a következőktől függenek:
– a vékonyréteg aktiválási állapota a kromatográfia időpontjában,
– a kromatográfiás kád hőmérséklete.
Példa a szilikagél vékonyrétegen kapott Rf értékekhez:
| Oldószer | |||
| 4.2.1.16.1. | 4.2.1.16.2. | ||
| Tioglikolsav | 0,25 | 0,80 | |
| 2-merkapto-propánsav | 0,40 | 0,95 | |
| 2,2’-ditio-di(ecet)sav | 0,00 | 0,35 | |
| 3-merkapto-propánsav | 0,45 | 0,95 | |
| 3-merkapto-1,2-propándiol | 0,45 | 0,35 | |
5. Mennyiségi meghatározás
A meghatározást mindig a jodometriás eljárással kell kezdeni.
5.1. Jodometria
5.2.1. Alapelv
A meghatározás az „-SH” csoport jódos oxidálásán alapul, savas közegben az alábbi egyenletnek megfelelően:
2 HOOC-CH2SH + I2 → (HOOC-CH2-S)2 + 2I– + 2 H+
5.1.2. Reagensek
Jódos mérőoldat 0,1 N,
5.1.3. Eszközök
Szokásos laboratóriumi felszerelés.
5.1.4. Eljárás
Pontosan mérjünk be egy 0,5 és 1 g közötti mennyiséget a mintából egy 150 ml-es dugóval ellátott Erlenmeyer lombikba, amely 50 ml desztillált vizet tartalmaz. Adjunk hozzá 5 ml sósavat (4.1.1.2.) (az oldat pH-ja 0 körül legyen) és titráljuk jód 0,1N oldattal (5.1.2.), amíg a sárga szín megjelenik. Alkalmazzunk indikátort (pl. keményítőoldatot vagy szén-tetrakloridot) igény szerint.
5.1.5. Számítás
A tioglikolsav tartalmat a következő képlet segítségével lehet kiszámítani:
| | % (m/m) = | 92 x n x 100 ────── 1000 x 10 x m | = | 0,92n ─── m |
ahol:
m = a kivett vizsgálati minta tömege (grammban),
n = a felhasznált jód 0,1 oldat (5.1.2.) térfogata.
5.1.6. Megjegyzések
Ha a kiszámított eredmény szerint a tioglikolsav töménysége az engedélyezett legnagyobb koncentráció 0,1%-a vagy ennél kevesebb, akkor nincs értelme további meghatározásokat végrehajtani. Ha az eredmény egyenlő vagy nagyobb mint a megengedett legnagyobb koncentráció, és az azonosítás több redukálószer jelenlétét mutatta ki, akkor szükséges a gázkromatográfiás meghatározás végrehajtása.
5.2. Gázkromatográfia
5.2.1. Alapelv
A tioglikosavat elválasztjuk a hordozóanyagtól kadmium-di(acetát) oldattal történő kicsapatás segítségével. Diazometános metilálás után, amelyet helyben vagy előre készítünk el dietil-éteres oldatban, a tioglikosav metil-származékát gáz/folyadékkromatográfiával mérjük, metil-oktanoát belső standard alkalmazása mellett.
5.2.2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
5.2.2.1. Tioglikosav, 98%.
5.2.2.2. Sósav, d420 = 1,19 g/ ml.
5.2.2.3. Metanol.
5.2.2.4. Kadmium-di(acetát) dihidrát, 10%-os (m/v) vizes oldata.
5.2.2.5. Metil-oktanoát, 2%-os (m/v) metanolos oldata.
5.2.2.6. Acetát puffer oldat, 5 pH
Nátrium-acetát trihidrát, 77 g.
Jégecet, 27,5 g.
Ioncserélt víz egy liter végső térfogat eléréséig.
5.2.2.7. Sósav, 3 M oldat metanolban (5.2.2.3.), frissen készített.
5.2.2.8. N-metil-3-nitro-1-nitrozo-guanidin.
5.2.2.9. Nátrium-hidroxid, 5 M oldat.
5.2.2.10. Jód, 0,05 M standard oldat.
5.2.2.11. Dietil-éter.
5.2.2.12. Diazo-metán oldat N-metil-N-nitrozo-toluol-4-szulfonamidból készítve (Fieser, Reagents for Organic Synthesis, Wiley kiadó, 1967).
A kapott oldat kb. 1,5 g diazo-metánt tartalmaz 100 ml dietil-éterben. Mivel a diazometán mérgező és nagyon bomlékony gáz, minden kísérletet hatékony elszívófülke alatt kell végezni és kerülni kell a csiszolatos üvegeszközök alkalmazását (különleges eszközök állnak rendelkezésre ebből a célból).
5.2.3. Eszközök
5.2.3.1. Szokásos laboratóriumi berendezés.
5.2.3.2. Eszközök a diazo-metán előállítására a helyben történő metiláláshoz (lásd Fales, H.M., Jaouni, T.M. and Babashak, J.F., Analyt. Chem. 1973, 45, 2302).
5.2.3.3. Eszközök a diazo-metán a Fieser szerinti előzetes elkészítéséhez.
5.2.4. A minta előkészítése
Pontosan mérjünk be egy 50 ml-es centrifugacsőbe annyi mennyiségű mintát, hogy várhatóan 50–70 mg tioglikosavat kapjunk. Savasítsuk meg egy pár csepp tömény sósavval (5.2.2.2.), hogy kb. pH 3 oldatot kapjunk.
Adjunk hozzá 5 ml ioncserélt vizet és 10 ml acetát puffer oldatot (5.2.2.6.).
Ellenőrizzük pH papírral, hogy a pH értéke 5 körül legyen. Ezután adjunk hozzá 5 ml kadmium-di(acetát) oldatot (5.2.2.4.).
Várjunk 10 percet, majd centrifugáljuk legalább 15 percig 4000 g érték mellett.
Távolítsuk el a felülúszó folyadékot, amely tartalmazhat oldhatatlan zsírt (krém termékek esetében). Ezt a zsírt nem szabad összetéveszteni a tiolokkal, amelyek tömörítetten gyűlnek össze a cső alján. Ellenőrizzük, hogy nem történik csapadékkiválás, amikor a felülúszóhoz néhány csepp kadmium-di(acetát) oldatot (5.2.2.4.) adunk.
Ha a korábbi meghatározás kimutatta, hogy nincsenek további redukáló anyagok a tiolokon kívül, jodometriásan ellenőrizzük, hogy a felülúszó folyadékban lévő tiolok mennyisége nem haladja-e meg az eredeti mennyiség 6–8%-át.
Tegyünk 10 ml metanolt (5.2.2.3.) a csapadékot tartalmazó centrifugacsőbe és óvatosan oszlassuk el a csapadékot keverő segítségével. Centrifugáljuk ismét legalább 15 percig 4000 g mellett. Öntsük el a felülúszót és ellenőrizzük annak tiolmentességét.
Mossuk a csapadékot még egyszer ugyanezzel az eljárással.
Még mindig ugyanazt a centrifugacsövet használva, adjunk hozzá:
– 2 ml metil-oktanoát oldatot (5.2.2.5.),
– 5 ml metanolos sósavat (5.2.2.7.).
Oldjuk fel teljesen a tiolokat (egy kevés oldhatatlan csapadék megmaradhat a hordozóanyagból). Ez az oldat az „S” oldat.
Ennek az oldatnak egy részletén jodometriásan ellenőrizzük, hogy a tioltartalom legalább 90%-a annak, amit korábban az 5.1. pontban kaptunk.
5.2.5. Metilálás
A metilálást vagy a folyamat során helyben (5.2.5.1.), vagy előre elkészített diazometánnal (5.2.5.2.) végezzük.
5.2.5.1. Helyben történő metilálás
A metiláló eszközökbe (5.2.3.2.), ami 1 ml étert (5.2.2.11.) tartalmaz tegyünk 50 μl „S” oldatot és metiláljunk az (5.2.3.2.) módszer szerint, kb. 300 mg
N-metil-3-nitro-1-nitrozo-guanidin (5.2.2.8.) felhasználásával. 15 perc után (az éteres oldatnak sárga színűnek kell lennie a diazo-metán felesleg jelenléte miatt) tegyük a mintaoldatot egy 2 ml-es üvegcsébe, amelyiknek légmentes dugója van. Tegyük éjszakára hűtőszekrénybe. Metiláljunk két mintát párhuzamosan.
5.2.5.2. Metilálás előre elkészített diazo-metán oldattal
Tegyünk egy 5 ml-es, dugóval ellátott lombikba 1 ml diazo-metán oldatot (5.2.2.12.) és 50 μl „S” oldatot. Tegyük éjszakára hűtőszekrénybe.
5.2.6. A standard elkészítése
Készítsünk el egy ismert erősségű standard tioglikosav oldatot (5.2.2.1.), ami kb. 60 mg tiszta tioglikosavat (5.2.2.1.) tartalmaz 2 ml-ben.
Ez az „E” oldat.
Csapassunk ki, mérjünk és metiláljunk az 5.2.4. és az 5.2.5. pont szerinti eljárásnak megfelelően.
5.2.7. Gázkromatográfiás körülmények
5.2.7.1. Oszlop
Típus: rozsdamentes acél
Hossz: 2 m
Átmérő: 3 mm
5.2.7.2. Töltet
20% didecil-ftalát, kromoszorb, WAW 80–100 mesh szemcseméret.
5.2.7.3. Detektor
Lángionizációs. Megfelelő érzékenységű beállítás a lángionizációs detektor elektrométere számára a 8 x 10–10 A.
5.2.7.4. Gázellátás
Vivőgáz: nitrogén.
nyomás: 2,2 bar.
áramlási sebesség: 35 ml/perc.
Segédgáz: hidrogén.
nyomás: 1,8 bar.
áramlási sebesség: 15 ml/perc.
Detektor ellátás: a detektor gyártójának előírásai szerint.
5.2.7.5. Hőmérsékleti körülmények
Befecskendezési hely: 200 °C,
Detektor: 200 °C,
Oszlop: 90 °C.
5.2.7.6. A papíradagolás sebessége
5 mm/perc.
5.2.7.7. Befecskendezett mennyiség
3 μl. Végezzünk öt befecskendezést.
5.2.7.8. A kromatográfia körülményei útmutatás céljából vannak megadva. Ezek lehetővé teszik, hogy az oszlop „R” felbontása 1,5 vagy annál jobbat eredményezzen, ahol:
| | R = 2 | d’ (r2 – r1) ───── W1 + W2 |
legyen:
r1 és r2 = retenciós idő (percben),
W1 és W2 = a csúcsoknak a magasság felénél mért szélessége (milliméterben),
d’ = a papíradagolás sebessége (milliméter/percben kifejezve).
Ajánlott, hogy a kromatográfia befejezésekor a hőmérsékletet 10 °C/perc sebességgel 90 °C-ról 150 °C-ra növeljük annak érdekében, hogy a következő méréseket esetlegesen zavaró vegyületeket eltávolítsuk.
5.2.8. Számítások
5.2.8.1. A arányossági tényező a tioglikosav esetében
Ezt a metil-oktanoátra vonatkoztatva számítjuk ki a standard keverék alapján legyen:
t = tioglikosavat
kt = az arányossági tényezője,
m’t = a tömege (milligrammban) a keverékben,
S’t = a csúcsterülete.
c = metil-oktanoát
legyen:
m’c = a tömege a keverékben (milligrammban),
S’c = a csúcsterülete,
akkor:
| | kt = | m’t ── m’c | x | S’c ── S’t |
Ez a tényező az alkalmazott eszközöktől függően változik.
5.2.8.2. A mintában lévő tioglikosav koncentrációja
legyen:
t = tioglikosavat:
kt = az arányossági tényezője,
St = a csúcsterülete.
c = metil-oktanoátot
legyen:
mc = „c” tömege a keverékben (milligrammban),
Sc = a csúcsterülete,
M = a kezdeti vizsgálati minta tömege (milligrammban),
akkor:
| | mc ── M | x | kt x St ───── Sc | x 100 |
6. Ismételhetőség *
8%-os (m/m) tioglikosav tartalom esetén azonos mintán párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,8%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer minden kozmetikai termék esetében alkalmazható.
2. Alapelv
A mintában lévő hexaklorofént etil-acetáttal kivonjuk és vékonyréteg kromatográfiával azonosítjuk.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Kénsav, 4 M oldat.
3.2. Celite AW.
3.3. Etil-acetát.
3.4. Oldószer: benzol, ami 1% (v/v) jégecetet tartalmaz.
3.5. I. előhívószer:
Rhodamine B oldat: oldjunk fel 100 mg Rhodamine B-t 150 ml dietil-éter, 70 ml abszolút etanol és 16 ml víz keverékében.
3.6. II. előhívószer:
2,6-dibróm-4-(klórimino)-2,5-ciklohexadienon oldat: oldjunk fel 2,6-dibróm-4(klórimino)-2,5-ciklohexadienont 100 ml metanolban (naponta frissen készítsük). Nátrium-karbonát oldat: oldjunk fel 10 g nátrium-karbonátot 100 ml ioncserélt vízben.
3.7. Összehasonlító oldat:
Készítsünk hexaklorofén, 0,05%-os (m/v) etil-acetátos oldatból.
4. Eszközök
4.1. Kiesel gél 254 TLC lapok, 200x200 mm (vagy ezzel egyenértékű).
4.2. Szokásos TLC berendezés.
4.3. Hősszabályozós fürdő 26 °C-ra beállítva a kromatográfiás kád számára.
5. A vizsgálati minta előkészítése
5.1. Alaposan keverjünk össze 1 g homogenizált mintát 1 Celite AW-vel (3.2.) és 1 ml kénsavval (3.1.).
5.2. Szárítsuk 100 °C-on, két órán keresztül.
5.3. Hűtsük le és finoman törjük porrá a megszáradt maradékot.
5.4. Végezzünk két kivonást, 10 ml etil-acetáttal (3.3.) mindkét alkalommal, centrifugáljuk minden kivonás után és egyesítsük az etil-acetátos rétegeket.
5.5. Párologtassuk el 60 °C-on.
5.6. Oldjuk fel a maradékot 2 ml etil-acetátban (3.3.).
6. Eljárás
6.1. Vigyünk fel 2 μl-t a vizsgálati mintaoldatból (5.6.) és 2 μl-t az összehasonlító oldatból (3.7.) egy TLC lapra (4.1.).
6.2. Telítsük a kádat (4.3.) az oldószerrel (3.4.).
6.3. Tegyük a TLC lapot a kádba és futtassuk 150 mm magasságig.
6.4. Távolítsuk el a TLC lapot és szárítsuk meg egy szellőztetett kemencében kb. 105 °C-os hőmérsékleten.
6.5. Kimutatás
A hexaklorofén cseppeket a vékonyrétegen a 6.5.1. vagy 6.5.2. pont szerint lehet kimutatni.
6.5.1. Permetezzük az I. előhívószert (3.5.) a lapra. 30 perc után vizsgáljuk meg a lapot UV fény alatt 254 mm-en.
6.5.2. Permetezzük a II. előhívószer 2,6-dibróm-4-(klórimino)-2,5-ciklohexadienon oldatát (3.6.) a lapra. Ezután szórjunk a lapra nátrium-karbonát oldatot (3.6.). 10 perc után, napfény mellett, szobahőmérsékleten szárítva vizsgáljuk meg a lapot.
7. Az eredmények értelmezése
7.1. I. előhívószer (3.5.):
A hexaklorofén kékes foltként jelenik meg egy sárga-narancssárga fluoreszcens háttéren, kb. 0,5 Rf értékkel.
7.2. II. előhívószer (3.6.):
A hexaklorofén égszínkék-türkizkék színű foltként jelenik meg fehér háttéren, kb. 0,5 Rf értékkel.
1. Cél és alkalmazási terület
Ez a módszer minden kozmetikai termék esetében alkalmazható.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott hexaklorofén tartalmát a hexaklorofén tömegszázalékában fejezzük ki.
3. Alapelv
A hexaklorofén mennyiségi meghatározása, metilszármazékká alakítása után gázkromatográfiával történik elektronbefogásos detektor segítségével.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Etil-acetát.
4.2. N-metil-N-nitrozo-p-toluol-szulfonamid (diazald).
4.3. Dietil-éter.
4.4. Metanol.
4.5. 2-(2-etoxi-etoxi)-etanol (karbitol).
4.6. Hangyasav.
4.7. Kálium-hidroxid, 50%-os (m/m) vizes oldat (naponta frissen készítsük).
4.8. Hexán a spektroszkópiához.
4.9. Brómklorofén (1. számú standard).
4.10. 4,4’,6,6’-tetraklór-2,2’-tiodifenol (2. számú standard).
4.11. 2,4,4’-triklór-2-hidroxi-difenil-éter (3. számú standard).
4.12. Aceton.
4.13. 4 M kénsav.
4.14. Celite AW.
4.15. Hangyasav etil-acetátos, 10%-os (v/v) oldata.
4.16. Hexaklorofén.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Diazo-metán készítésére alkalmas mini eszközök (Analyt. Chem., 1973, 45, 2302-3,).
5.3. Gázkromatográf, 63 Ni forrásból származó elektronbefogásos detektorral felszerelve.
6. Eljárás
6.1. A hitelesítő oldat előkészítése
A standardot úgy kell kiválasztani, hogy az ne zavarja a vizsgálati termék hordozóanyagában lévő egyik összetevőt se. Általában az 1. számú standard (4.9.) a legalkalmasabb.
6.1.1. Pontosan mérjünk be kb. 50 mg-ot az 1. (4.9.), a 2. (4.10.) vagy a 3. (4.11.) számú standardból és 50 mg hexaklorofént (4.16.) egy 100 ml-es mérőlombikba. Töltsük fel a jelig etil-acetáttal (4.1.) (A oldat). Hígítsuk fel az A oldat 10 ml-ét 100 ml-re etil-acetáttal (4.1.) (B oldat).
6.1.2. Pontosan mérjünk be kb. 50 mg-ot az 1. (4.9.), a 2. (4.10.) vagy a 3. (4.11.) számú standardból egy 100 ml-es mérőlombikba. Töltsük fel a jelig etil-acetáttal (4.1.) (C oldat).
6.2. A minta előkészítése *
Pontosan mérjünk be 1 g-ot a homogenizált mintából és keverjük alaposan össze 1 ml kénsavval (4.13.), 15 ml acetonnal (4.12.) és 8 g Celite AW-vel (4.14.). Szárítsuk a keveréket levegőn 30 percig gőzfürdőre téve, azután szárítsuk másfél órán keresztül szellőztetett kemencében. Hűtsük le, finoman törjük porrá a maradékot és tegyük át egy üveg oszlopba. Oldjuk etil-acetáttal (4.1.) és gyűjtsünk össze 100 ml-t. Adjunk hozzá 2 ml belső standardot (C oldat) (6.1.2.).
6.3. A minta metilálása
Hűtsük az összes reagenst és a készüléket 0 és 4 °C között két órán keresztül. A diazo-metán készülék külső rekeszébe tegyünk 1,2 ml-t a 6.2. pont szerint kapott oldatból, és 0,1 ml metanolt (4.4.). Tegyünk kb. 200 mg diazaldot (4.2.) a középső tárolóba, adjunk hozzá 1 ml karbitolt (4.5.) és 1 ml dietil-étert (4.3.), és oldjuk fel. Szereljük össze a készüléket majd félig eresszük egy 0 °C-os fürdőbe és fecskendő segítségével tegyünk 1 ml lehűtött kálium-hidroxid oldatot (4.7.) a középső tárolóba. A diazo-metán hatására sárga szín képződik, ami megmarad. Ha a sárga szín nem marad meg, ismételjük meg a metilálást további 200 mg diazald (4.2.) hozzáadásával. *
A készüléket vegyük ki a fürdőből 15 perc után, és szobahőmérsékleten hagyjuk lezárva 12 órára. Ezt követően nyissuk ki a készüléket, reagáltassuk el a diazo-metán felesleget néhány csepp 10%-os (v/v) etil-acetátos hangyasav oldattal (4.15.) és tegyük át a szerves oldatot egy 25 ml-es mérőlombikba. Töltsük fel jelig hexánnal (4.8.).
Fecskendezzünk be 1,5 μl-t ebből az oldatból a kromatográfba.
6.4. A standard metilálása
Hűtsük az összes reagenst és a készüléket 0 és 4 °C között két órán keresztül. A diazo-metán készülék külső rekeszébe tegyük a következőket:
0,2 ml B oldat (6.1.1.),
1 ml etil-acetát (4.1.),
0,1 ml metanol (4.4.).
Hajtsuk végre a metilálást a 6.3. szerint. Fecskendezzünk be 1,5 μl-t a létrejött oldatból a kromatográfba.
7. Gázkromatográfia
Az oszlop felbontásával „R” 1,5 vagy annál nagyobb kell, hogy legyen, ahol:
| | R = 2 | d’ (r2 – r1) ───── W1 + W2 |
legyen:
r1 és r2 = retenciós idők (percben),
W1 és W2 = a csúcsoknak a magasság félénél mért szélessége (milliméterben),
d’ = a papíradagoló-sebesség (milliméter/percben kifejezve).
Példaként a következő kromatográfiás körülmények a kívánt eredményt adják:
Oszlop: rozsdamentes acél
Hossz: 1,7 m
Átmérő: 3 mm
Hordozó:
kromoszorb: WAW
szitaanalízis: 80–100 mesh.
Álló fázis: 10% OV 17.
Hőmérsékletek:
oszlop: 280 °C,
befecskendezési: 280 °C,
detektor: 280 °C.
Vivőgáz: oxigénmentes nitrogén.
Nyomás: 2,3 bar.
Áramlási sebesség: 30 ml/perc.
8. Számítás
8.1. A hexaklorofén arányossági tényezője
Ezt a választott standardhoz viszonyítva számíthatjuk ki a standard keverékre vonatkoztatva:
Legyen:
h = a hexaklorofén,
kh = az arányossági tényezője,
m’h = a tömege a keverékben (grammban),
A’h = a csúcsterülete,
s = a választott standard,
m’s = a tömege a keverékben (grammban),
A’s = a csúcsterülete
akkor:
| | kh = | m’h ── m’s | x | A’c ── A’h |
8.2. A mintában lévő hexaklorofén koncentrációja
Legyen:
h = a hexaklorofén,
kh = az arányossági tényezője,
An = a csúcsterülete,
s = a választott standard,
ms = a tömege a keverékben (grammban),
Ac = a csúcsterülete,
M = a felhasznált vizsgálati minta tömege (grammban),
akkor a hexaklorofén%-os (m/m) aránya a mintában:
| | ms x kh x Ah x 100 ───────── M x As |
9. Ismételhetőség *
0,1%-os (m/m) nitro-metán tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,005%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer a tozil-klóramid-nátrium (klóramin-T) vékonyréteg kromatográfiás mennyiségi meghatározását írja le kozmetikai termékekben.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott klóramin-T tartalmát tömegszázalékban (m/m) fejezzük ki.
3. Alapelv
A klóramin-T-t sósavas forralással teljesen elhidrolizáljuk 4-toluol-szulfonamiddá.
A képződött 4-toluol-szulfonamidot mennyiségét foto-denzitometriásan vékonyréteg kromatográfiával határozzuk meg.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Tozil-kóramid-nátrium (klóramin-T).
4.2. 4-toluol-szulfonamid standard oldata: 50 mg 4-toluol-szulfonamid 100 ml etanolban (4.5.).
4.3. Sósav, 37%-os (m/m), d420 = 1,18 g/ ml.
4.4. Dietil-éter.
4.5. Etanol, 96% (v/v).
4.6. Előhívó oldat.
4.6.1. 1-butanol/etanol (4.5.)/víz (40: 4: 9; v/v/v), vagy
4.6.2. Kloroform/aceton (6:4; v/v).
4.7. Előkészített vékonyréteg lapok, szilikagél 60, fluoreszcens indikátor nélkül.
4.8. Kálium-permanganát.
4.9. Sósav, 15% (m/m).
4.10. Permetező-reagens: 2-toluidin, 1%-os (m/v) etanolos (4.5.) oldat.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Szokásos vékonyréteg kromatográfiás berendezés.
5.3. Foto-denzitométer.
6. Eljárás
6.1. Hidrolízis
6.1.1. Pontosan mérjünk be egy 50 ml-es gömblombikba kb. 1 g mintát (m). Adjunk hozzá 5 ml vizet és 5 ml sósavat (4.3.) majd forraljuk egy órán keresztül, visszafolyós hűtő alkalmazásával. A forró szuszpenziót azonnal tegyük át vízzel egy 50 ml-es mérőlombikba. Hagyjuk lehűlni és töltsük fel a jelig vízzel. Centrifugáljuk legalább 3000-es fordulatszámon (rpm) öt percig majd eresszük át a felülúszó folyadékot egy szűrőn.
6.2. Kivonás
6.2.1. Vegyünk ki 30 ml-t a szűrletből és végezzünk három kivonást 15 ml dietil-éterrel (4.4.). Szükség esetén szárítsuk meg az éteres fázisokat majd gyűjtsük össze egy 50 ml-es mérőlombikba, és töltsük fel a jelig dietil-éterrel (4.4.).
6.2.2. Vegyünk ki 25 ml-t a szárított éteres kivonatból és nitrogénáramban párologtassuk szárazra. Oldjuk fel újra a maradékot 1 ml etanolban (4.5.).
6.3. Vékonyréteg kromatográfia
6.3.1. Cseppentsünk 20 μl-t az etanolos maradékból (6.2.) egy vékonyréteg kromatográfiás lapra (4.7.).
Ugyanekkor és ugyanilyen módon, tegyünk 8, 12, 16 és 20 μl-t a 4-toluol-szulfonamid standard oldatból a lapra.
6.3.2. Ezután hagyjuk kifejlődni kb. 150 mm-re a előhívó oldószerben (4.6.1. vagy 4.6.2.).
6.3.3. Az előhívó oldószer teljes elpárologtatása után tegyük a lapot 2–3 percre klórgőz atmoszférába, amelyet 100 ml sósav (4.9.) kb. 2 g kálium-permanganátra (4.8.) öntésével egy zárt edényben hozunk létre. Távolítsuk el a klórfelesleget, a lap öt percen keresztüli 100 °C-os hevítésével. Ezután permetezzük be a lapot a (4.10.) reagenssel.
6.4. Mérés
Nagyjából egy óra után mérjük meg a lila foltokat a foto-denzitométerrel 525 nm-en.
6.5. A standard görbék felrajzolása
Ábrázoljuk a legnagyobb csúcsértékeket, amelyeket a 4-toluol-szulfonamid cseppek (azaz 4, 6, 8, 10 μg cseppenként) esetében állapítottunk meg a 4-toluol-szulfonamid megfelelő mennyiségeivel szemben.
7. Megjegyzés
A módszert 0,1 vagy 0,2%-os (m/v) klóramin-T oldat (4.1.) alkalmazásával lehet ellenőrizni, amit a mintával (6.) azonos módon kezelünk.
8. Számítás
A minta klóramin-T tartalmát tömegszázalékban kifejezve a következő módon lehet kiszámítani:
| | % (m/m) tozil-kóramid-nátrium = | 1,33 x a ───── 60 x m |
ahol:
1,33 = a 4-toluol-szulfonamid/ klóramin-T átszámítási tényező,
a = a 4-toluol-szulfonamid mennyisége (μg-ban) a mintában a standard görbe leolvasása alapján,
m = a kivett minta tömege (grammban).
9. Ismételhetőség *
Kb. 0,2%-os (m/m) klóramin-T tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,03%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer a fogkrémekben található teljes fluortartalom mennyiségi meghatározására készült. A módszer legfeljebb 0,25% fluortartalom esetén alkalmazható.
2. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott fluortartalmát tömegszázalékban fejezzük ki.
3. Alapelv
A meghatározást gázkromatográfiával végezzük. A fluortartalmú vegyületekből származó fluort savas közegben, klór-trietil-szilánnal (TECS) való közvetlen reakcióval trietil-fluor-szilánná (TEFS) alakítjuk át, és egyidejűleg xilolt tartalmazó ciklohexánnal, mint belső standarddal vonjunk ki.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Nátrium-fluorid, 120 °C-on tömegállandóságig szárított.
4.2. Kétszer desztillált vagy azzal megegyező minőségű víz.
4.3. Sósav, d420 = 1,19 g/ml.
4.4. Ciklohexán (CH).
4.5. Xilol, amelynek nincs a kromatogramban az oldószercsúcs előtt csúcsa, ha a mintáéval (6.1.) azonos körülmények között kromatografálják. Szükség esetén desztillációval tisztítsuk (5.8.).
4.6. Klór-trietil-szilán (TECS Merck vagy azzal megegyező).
4.7. Fluor standard oldatok
4.7.1. Törzsoldat, 0,25 mg F–/ ml. Mérjünk be pontosan 138,1 mg nátrium-fluoridot (4.1.) és oldjuk fel vízben (4.2.). Veszteség nélkül vigyük át az oldatot egy 250 ml-es mérőlombikba (5.5.). Hígítsuk fel a jelig vízzel (4.2.) és keverjük össze.
4.7.2. Hígított törzsoldat, 0,05 mg F–/ ml. Vigyünk át pipettával 20 ml-t a törzsoldatból (4.7.1.) egy 100 ml-es mérőlombikba (5.5.). Hígítsuk fel a jelig vízzel és keverjük össze.
4.8. Belső standard oldat
Keverjünk össze 1 ml ciklohexánt (4.4.) és 5 ml xilolt (4.5.).
4.9. Klór-trietil-szilán/belső standard oldat
Vigyünk át pipettával (5.7.) 0,6 ml-t a TECS-ből (4.6.) és 0,12 ml-t a belső standard oldatból (4.8.) egy 10 ml-es mérőlombikba. Hígítsuk fel a jelig xilollal (4.5.) és keverjük össze. Naponta frissen készítsük.
4.10. Perklórsav, 70% (m/v).
4.11. Perklórsav, 20% (m/v), vízben (4.2.).
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Gázkromatográf, láng-ionizáció mérésére alkalmas detektorral felszerelve.
5.3. Vortex forgó keverő vagy azzal egyenértékű.
5.4. Bühler kémcsőrázó, SMB1 típusú vagy azzal egyenértékű.
5.5. Mérőlombikok, 100 és 250 ml-es, polipropilénből készített.
5.6. Centrifugacsövek (üveg); 20 ml-es teflonnal bélelt csavaros kupakkal, Sovirel 611-56-os típus vagy azzal megegyező. Tisztítsuk meg a csöveket és a csavaros kupakokat néhány órás perklórsavas (4.11.) áztatással, amelyet öt, egymást követő vizes (4.2.) öblítés, és végül 100 °C-os szárítás követ.
5.7. Pipetták, amelyek 50–200 μl térfogatra beállíthatók, egyszer használatos műanyag pipettaheggyel.
5.8. Desztillációs berendezés, három golyós Schneider oszloppal vagy egy annak megegyező Vigreux oszloppal felszerelve.
6. Eljárás
6.1. Minta elemzés
6.1.1. Válasszunk ki egy bontatlan fogkrémes tubust, nyissuk fel és távolítsuk el a teljes tartalmat. Tegyük ezt bele egy műanyag tartályba, keverjük össze alaposan és tároljuk olyan körülmények között, hogy az állagát megőrizze.
6.1.2. Mérjünk be pontosan 150 mg (m) mintát egy centrifugacsőbe (5.6.), adjunk hozzá 5 ml vizet (4.2.) és homogenizáljuk (5.3.).
6.1.3. Adjunk hozzá 1 ml xilolt (4.5.).
6.1.4. Adjunk hozzá cseppenként 5 ml sósavat (4.3.) és homogenizáljuk (5.3.).
6.1.5. Adjunk hozzá pipettával 0,5 ml klór-trietil-szilán/belső standard oldatot (4.9.) a centrifugacsőben (5.6.).
6.1.6. Zárjuk le a csövet csavaros kupakkal (5.6.) és keverjük alaposan 45 percen keresztül egy kémcsőrázógépben (5.4.), amelyet percenkénti 150-es ütemre állítottunk.
6.1.7. Centrifugáljuk 10 percet olyan sebességen, hogy a fázisok tisztán elváljanak egymástól, vegyük le a cső tetejét, nyerjük ki a szerves réteget és fecskendezzünk be a szerves fázisból 3 μl-t a gázkromatográfiás oszlopba (5.2.).
Megjegyzés: Kb. 20 percet vesz igénybe az összes összetevő kioldása.
6.1.8. Ismételjük meg a befecskendezést, számítsuk ki az átlagos csúcsterület-arányt (ATEFS/ACH) és olvassuk le az ehhez tartozó fluormennyiséget [milligrammban (m1)] a standard görbéről (6.3.).
6.1.9. Számítsuk ki a minta összes fluortartalmát a fluor tömegszázalékában a 7. pontban megadott módon.
6.2. Kromatográfiás körülmények
6.2.1. Oszlop: rozsdamentes acél.
Hossz: 1,8 mm.
Átmérő: 3 mm.
Hordozó: Gaschrom Q 80-100-as mesh.
Álló fázis: szilikon olaj DC 200 vagy azzal megegyező: 20%. Kondicionáljuk az oszlopot egy éjszakán keresztül 100 °C-on, a vivőgáz sebesség 25 ml nitrogén percenként. Ezt ismételjük minden éjszaka. Minden negyedik vagy ötödik befecskendezés után újrakondicionáljuk az oszlopot 30 perces 100 °C-os melegítéssel.
Hőmérsékletek:
oszlop: 70 °C
fecskendő: 150 °C
detektor: 250 °C
Vivőgáz: nitrogén 35 ml percenként
6.3. Standard görbe
6.3.1. Tegyünk pipettával egy hat centrifugacsőből (5.6.) álló sorozatba rendre 0, 1, 2, 3, 4 és 5 ml hígított fluorid standard oldatot (4.7.2.). Egészítsük ki minden cső tartalmát 5 ml-re vízzel (4.2.).
6.3.2. Járjunk el a 6.1.3.–6.1.6. pont között leírtak alapján, a 6.1.6. pontot is beleértve.
6.3.3. Fecskendezzünk be 3 μl-t a szerves fázisból a gázkromatográfiás oszlopba (5.2.).
6.3.4. Ismételjük meg a befecskendezést és számítsuk ki az átlagos csúcsterület-arányt (ATEFS/ACH)
6.3.5. Ábrázoljuk a standard görbét a standard oldatokban (6.3.1.) lévő fluor tömegének (milligrammban) és a 6.3.4. szerint mért csúcsterület-aránynak (ATEFs/ACH) az összefüggésével. Kössük össze az ábra pontjait a regressziós analízis segítségével kapott legjobban illeszkedő egyenessel.
7. Számítás
A minta összes fluortartalmának koncentrációját (a fluor tömegszázalékában) [% (m/m) F] a következőképpen adhatjuk meg:
| | % F = | m1 ─ m | x 100 |
ahol:
m = az vizsgálati minta (milligrammban) (6.1.2.),
m1 = a standard görbéről (6.1.8.) leolvasott a fluor mennyisége (milligrammban)
8. Ismételhetőség *
0,15%-os (m/m) fluortartalom esetén azonos mintán párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,012%-ot (m/m).
Cél és alkalmazási terület
Az alább leírt módszer azoknak a szerves higanyszármazékok azonosítására és mennyiségi meghatározására alkalmazható, amelyeket a szemen használatos kozmetikai termékben tartósítóként használnak fel. Ez a módszer a tiomersalra (INN) (nátrium-2-(etil-higany-tio)-benzoát) és a fenil-higanyra, valamint ezek sóira alkalmazható.
1. Alapelv
A szerves higanyvegyületeket ditizonáttal komplexáljuk. A ditizonát szén-tetrakloridos kivonása után, szilikagél vékonyréteg kromatográfiát végzünk. A ditizonát foltok narancssárga színnel jelennek meg.
2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
2.1. Kénsav, 25% (v/v).
2.2. 1,5-difenil-3-tiokarbazon (ditizon): 0,8 mg 100 ml szén-tetrakloridban (2.4.).
2.3. Nitrogén.
2.4. Szén-tetraklorid.
2.5. Előhívó oldószer: hexán/aceton, 90:10 (v/v).
2.6. Standard oldat, 0,001%-os, vízben a következőkből:
nátrium-2-(etil-higany-tio)-benzoát,
etil-higany-klorid vagy metil-higany-klorid,
fenil-higany-nitrát vagy fenil-higany-acetát,
higany-diklorid vagy higany-di(acetát).
2.7. Készgyártmány szilikagél lapok (pl. Merck 5721 vagy azzal egyenértékű).
2.8. Nátrium-klorid.
3. Eszközök
3.1. Szokásos laboratóriumi felszerelés.
3.2. Szokásos TLC berendezés.
3.3. Fázis-elválasztó szűrő.
4. Eljárás
4.1. Kivonás
4.1.1. Hígítsunk fel 1 g mintát egy centrifugacsőben 20 ml desztillált vízzel titrálva. Érjük el a legnagyobb diszpergálódást egy 60 °C-ra fel melegített vízfürdőben. Adjunk hozzá 4 g nátrium-kloridot (2.8.). Rázzuk össze. Hagyjuk lehűlni.
4.1.2. Centrifugáljuk legalább 20 percig 4500 fordulat/percen, a szilárd fázis nagy részének a leválasztása céljából. Szűrjük bele egy választótölcsérbe és adjunk hozzá 0,25 ml kénsav oldatot (2.1.).
4.1.3. Végezzünk néhány kivonást 2 vagy 3 ml ditizon oldattal (2.2.), amíg az utolsó szerves fázis zöld marad.
4.1.4. Szűrjük le az összes szerves fázist egymás után egy fázis-elválasztó szűrőn (3.3.) keresztül.
4.1.5. Pároljuk szárazra nitrogénáram alatt (2.3.).
4.1.6. Oldjuk fel 0,5 ml szén-tetrakloriddal (2.4.). Alkalmazzuk ezt az oldatot azonnal, a 4.2.1. pontban leírtaknak megfelelően.
4.2. Elválasztás és azonosítás
4.2.1. Tegyünk 50 μl-t a 4.1.6. szerint kapott szén-tetrakloridos oldatból a szilikagél lapra (2.7.). Ezzel párhuzamosan kezeljünk 10 ml standard oldatot is (2.6.) a 4.1. pont szerint és vigyünk fel 50 μl-t a 4.1.6. szerint kapott oldatból ugyanarra a lapra.
4.2.2. Tegyük a lapot az oldószerbe (2.5.) és hagyjuk, hogy ez utóbbi 150 mm magasra fusson. A szerves higanyvegyületek színes folt formájában jelennek meg, amelyek színe állandó, feltéve, hogy a lapot közvetlenül az oldószer elpárolgása után üveglappal lefedtük.
Példaként, a következő Rf értékeket lehet kapni:
| Rf | Szín | ||
| Thiomersal | 0,33 | Narancs | |
| Etil-higany-klorid | 0,29 | Narancs | |
| Metil-higany-klorid | 0,29 | Narancs | |
| Fenil-higany és sói | 0,21 | Narancs | |
| Higany-diklorid | 0,10 | Narancs | |
| Higany-di(acetát) | 0,10 | Narancs | |
| 1,5-difenil-3-tiokarbazon | 0,09 | Rózsaszín |
1. Fogalommeghatározás
Az ezzel a módszerrel meghatározott szerves higanyvegyület tartalmat a mintában lévő higany tömegszázalékában (m/m) fejezzük ki.
2. Alapelv
A módszer a jelen lévő teljes higanymennyiség mérésén alapszik. Ezért szükséges, hogy először megbizonyosodjunk arról, hogy nincs jelen szervetlen higany és arról, hogy azonosítottuk a mintában lévő szerves higanyszármazékokat. Ásványosítás után a higanyt felszabadítjuk és lángmentes atomabszorpcióval mérjük.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Tömény salétromsav, d420 = 1,41 g/ml.
3.2. Tömény kénsav, d420 = 1,84 g/ml.
3.3. Kétszer-desztillált (bidesztillált) víz.
3.4. Kálium-permanganát, 7%-os (m/v) oldat.
3.5. Hidroxil-ammónium-klorid, 1,5%-os (m/v) oldat.
3.6. Dikálium-peroxi-diszulfát, 5%-os (m/v) oldat.
3.7. Ón-diklorid, 10%-os (m/v) oldat.
3.8. Tömény sósav, d420 = 1,18 g/ml.
3.9. Palládium-dikloriddal impregnált üveggyapot, 1% (m/m).
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés.
4.2. Berendezés a higany lángmentes atomabszorpciós meghatározására (hideg gőz technika), beleértve a szükséges üvegeszközöket. A mérőcella úthossza legalább 100 mm legyen.
5. Eljárás
Tartsunk be minden szükséges óvintézkedést a higany nyomok elemzésénél.
5.1. Lebontás
5.1.1. Pontosan mérjünk be 150 mg mintát (m). Adjunk hozzá 10 ml salétromsavat (3.1.) és hagyjuk a feltáródást előrehaladni három órán keresztül 55 °C-os vízfürdőben, egy légmentesen lezárt lombikban, rendszeres időközönként rázzuk meg. Ezzel egy időben hajtsunk végre vakpróbát.
5.1.2. Lehűlés után adjunk hozzá 10 ml kénsavat (3.2.) és tegyük vissza az 55 °C-os vízfürdőbe 30 percre.
5.1.3. Tegyük a lombikot jégfürdőbe és óvatosan adjunk hozzá 20 ml vizet (3.3.).
5.1.4. 2 ml-es adagokban adjunk hozzá 7%-os kálium-permanganát oldatot (3.4.), amíg az oldat színe megmarad. Tegyük vissza az 55 °C-os vízfürdőbe további 15 percre.
5.1.5. Adjunk hozzá 4 ml dikálium-peroxi-diszulfát oldatot (3.6.). Tegyük vissza ismét az 55 °C-os vízfürdőbe további 30 percre.
5.1.6. Hagyjuk lehűlni és vigyük át a lombik tartalmát egy 100 ml-es normál lombikba. Öblítsük át a lombikot 5 ml hidroxil-ammónium-kloriddal (3.5.) és azután öblítsük még ki 4-szer 10 ml vízzel (3.3.). Az oldatnak teljesen színtelenné kell válnia. Töltsük fel a jelig vízzel (3.3.).
5.2. Mennyiségi meghatározás
5.2.1. Tegyünk a vizsgálati oldatból (5.1.6.) az üvegedénybe (4.2.) 10 ml-t a hideg- gőzös higany meghatározásához. Hígítsuk fel 100 ml vízzel (3.3.) és ezután adjunk hozzá 5 ml kénsavat (3.2.), illetve 5 ml ón-diklorid oldatot (3.7.). Keverjük össze minden hozzáadás után. Várjunk 30 másodpercet, hogy az összes ionos higany fém állapotúvá redukálódhasson és olvassuk le a kapott értéket. Legyen n a leolvasott érték.
5.2.2. Tegyünk egy kevés palládium-dikloriddal impregnált üveggyapotot (3.9.) a higanyredukáló edény és a mérőcella (4.2.) közé. Ismételjük meg az 5.2.1. eljárást és jegyezzük fel a leolvasott értéket. Ha a leolvasott érték nem nulla, akkor az ásványosítás nem volt teljes, és az elemzést meg kell ismételni.
6. Számítás
Legyen:
m = a vizsgálati minta tömege (grammban),
n = a készülékről leolvasott higany mennyisége (μg-ban).
A higany mennyiségét a higany tömegszázalékában kifejezve a következő képlet segítségével számíthatjuk ki:
| | % higany = | n ─ m |
7. Megjegyzések
7.1. Az ásványosítás javításához szükséges lehet előzetesen hígított mintából kiindulni.
7.2. Ha feltételezhető, hogy az alapanyag higanyt abszorbeál, akkor a standard hozzáadások módszerével kell a mennyiségi meghatározást elvégezni.
8. Ismételhetőség *
0,007%-os higany tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,00035%-ot.
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben lévő szulfidok mennyiségi meghatározását írja le. Tiolok vagy más redukáló szerek (beleértve a szulfitokat) jelenléte nem zavaró.
2. Fogalommeghatározás
Az ezzel a módszerrel meghatározott szulfidtartalmat a kén tömegszázalékban fejezzük ki.
3. Alapelv
A közeg savasítása után a hidrogén-szulfidot nitrogénáramban elvezetjük és kadmium-szulfid formájában megkötjük. Az utóbbit leszűrjük és átöblítjük, majd jodometriásan mérjük.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Tömény sósav, d420 = 1,19 g/ml.
4.2. Nátrium-tioszufát, 0,1 N standard oldat.
4.3. Jód, 0,1 N standard oldat.
4.4. Dinátrium-szulfid.
4.5. Kadmium-di(acetát).
4.6. Tömény ammónia, d420 = 0,90 g/ml.
4.7. Kadmium-di(acetát) ammóniás oldata: oldjunk fel 10 g kadmium-di(acetátot) (4.5.) kb. 50 ml vízben. Adjunk hozzá ammóniát (4.6.) amíg a csapadék újra feloldódik (azaz kb. 20 ml-t). Töltsük fel a 100 ml-es jelig vízzel.
4.8. Nitrogén.
4.9. M ammónia oldat.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Három 100 ml-es a szabványnak megfelelő csiszolatos gömblombik.
5.3. Két 150 ml-es csiszolt-üveg nyakú Erlenmeyer lombik, amely fel van szerelve egy bemerülő csövet és az elvezetendő gáz oldalsó kivezetésére szánt csövet tartalmazó eszközzel.
5.4. Egy hosszú szárú tölcsér.
6. Eljárás
6.1. A szulfidok elvezetése
6.1.1. Vegyünk egy bontatlan csomagolású vizsgálati mintát. Pontosan mérjünk be a mintából az Erlenmeyer lombikba (5.2.) legfeljebb 30 mg szulfidionnak megfelelő mennyiséget (m) (grammban kifejezve). Adjunk hozzá 60 ml vizet és két csepp habzásgátló folyadékot.
6.1.2. Vigyünk át 50 ml oldatot (4.7.) mindkét Erlenmeyer lombikba (5.3.).
6.1.3. Szereljünk fel egy csepegtető tölcsért, valamint szereljük fel a bemerülő csövet és a kivezető csövet az Erlenmeyer lombikra (5.2.). Csatlakoztassuk a kivezető csövet a PVC csővel sorba kötött lombikokra (5.3.).
Megjegyzés: Az elvezető készüléknek meg kell felelnie a következő szivárgásmentességi vizsgálatnak: a vizsgálati körülmények modellezéséhez helyettesítsük a vizsgálati terméket 10 ml szulfid oldattal (a 4.4.-ből készítve), amely „X mg” szulfidot tartalmaz (jodometriásan meghatározva). Legyen „Y” a szulfid milligrammjainak száma, amelyet ennek a műveletnek a végén kapunk. „X” és az Y” mennyisége közötti különbség nem haladhatja meg a 3%-ot.
6.1.4. Hajtsunk át 15 percen keresztül nitrogént (4.8.), két buborék/másodperc sebességgel az Erlenmeyer lombikban (5.2.) található levegő kihajtása céljából.
6.1.5. Melegítsük fel a Erlenmeyer lombikot 85 ± 5 °C-ra.
6.1.6. Állítsuk le a nitrogénáramot (4.8.) és adjunk hozzá cseppenként 40 ml sósavat (4.1.).
6.1.7. Indítsuk el ismét a nitrogénáramot (4.8.), amikor már majdnem az összes sav lecsepegett úgy, hogy hagyjunk meg egy kevés folyadékot a hidrogén-szulfid elszivárgásának megakadályozása érdekében.
6.1.8. Szüntessük meg a melegítést 30 perc után. Hagyjuk a lombikot (5.2.) lehűlni és folytassuk a nitrogén (4.8.) átáramoltatását legalább másfél óráig.
6.2. Titrálás
6.2.1. Szűrjük le a kadmium-szulfidot egy hosszú szárú szűrőn (5.4.).
6.2.2. Mossuk át az Erlenmeyer lombikokat (5.3.) először ammónia oldattal (4.9.) és öntsük a szűrőre. Ezután mossuk desztillált vízzel és használjuk fel a vizet a szűrőn maradt csapadék mosására.
6.2.3. Fejezzük be a csapadék mosását 100 ml vízzel.
6.2.4. Tegyük a szűrőpapírt az első Erlenmeyer lombikba, amelyik a csapadékot tartalmazta. Adjunk hozzá 25 ml (n1) jódoldatot (4.3.), kb. 20 ml sósavat (4.1.) és 50 ml desztillált vizet.
6.2.5. Határozzuk meg a jódfelesleget nátrium-tioszulfát oldattal (n2) (4.2.).
7. Számítás
A minta szulfidtartalma a kén tömegszázalékában kifejezve a következő képlet segítségével számítható ki:
| | % kén = | 32 (n1x1 – n2x2) ─────── 20 m |
ahol:
n1 = a felhasznált standard jódoldat (4.3.) mennyisége (milliliterben),
x1 = ennek az oldatnak a molaritása,
n2 = a felhasznált standard nátrium-tioszulfát oldat (4.2.) száma (milliliterben),
x2 = ennek az oldatnak a molaritása,
m = a vizsgálati minta tömege (grammban).
8. Ismételhetőség *
2%-os (m/m) szulfidtartalom esetén azonos mintán, párhuzamosan végzett mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,2%-ot (m/m).
(A 83/514/EGK irányelv alapján)
1. Cél és alkalmazási terület
Ez a módszer kimutatja a monogliceril-(4-amino)-benzoátot vagy (1-glicerin-(4-amino)-benzoátot). Szintén kimutatja az etil-(4-amino)-benzoátot (benzokain, INN), amely szennyeződésként lehet jelen.
2. Alapelv
Ez az azonosítás vékonyréteg kromatográfiával szilikagélen fluoreszcens indikátorral és a szabad primer amin-csoport által, a lapon képzett diazo festék kimutatásával történik.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Oldószerkeverék: ciklohexán/izopropanol/stabilizált diklór-metán 48/64/9 (v/v/v).
3.2. Futtatóoldat: petroléter (40–60)/benzol/aceton/ammónium-hidroxid oldat (minimum 25% NH3): 35/35/35/1 (v/v/v/v).
3.3. Előhívó oldat:
a) nátrium-nitrit: 1 g 100 ml 1 M sósavban (közvetlenül a felhasználás előtt készítsük el);
b) 2-naftol: 0,2 g 100 ml 1 M kálium-hidroxidban.
3.4. Standard oldatok:
alfa-monogliceril-(4-amino)-benzoát: 0,05 g 100 ml 3.1. szerinti oldószerkeverékben; etil-(4-amino)-benzoát: 0,05 g 100 ml 3.1. szerinti oldószerkeverékben;
3.5. Szilikagél 60 F254 lapok, 0,25 mm vastag, 200 mm x 200 mm.
4. Eszközök
4.1. Általános vékonyréteg kromatográfia eszközei.
4.2. Ultrahangos készülék.
4.3. Millipore szűrő FH 0,5 μm vagy azzal megegyező.
5. Eljárás
5.1. Minta-előkészítés
Mérjünk be a vizsgálati mintából 1,5 g-ot egy 10 ml-es, dugóval ellátott mérőlombikba. Töltsük fel a jelig a 3.1. oldószerrel. Zárjuk le a dugóval és hagyjuk egy órára az ultrahangos készülékben (4.2.). Szűrjük át egy Millipore szűrőn (4.3.) és a szűrleten végezzük el a kromatográfiát.
5.2. Vékonyréteg kromatográfia
Vigyünk fel a mintaoldatból (5.1.) és minden standard oldatból (3.4.) 10-10 μl-t a lapra (3.5.).
Futtassuk a kromatogramot 150 mm-es magasságig egy olyan futtatókádban, amelyet előzőleg a 3.2. oldószerrel telítettünk. Hagyjuk a lemezt a szobahőmérsékleten megszáradni.
5.3. Előhívás
5.3.1. Figyeljük meg a lemezt 254 nm-es UV fényben.
5.3.2. A teljesen megszárított lemezt permetezzük be a 3.3. a) oldattal.
Hagyjuk szobahőmérsékleten 1 percig száradni és azonnal permetezzük be a 3.3. b) oldattal.
Szárítsuk a lemezt 60 °C-os kemencében. A foltok narancs színben tűnnek elő, a következő Rf-kel: alfa-monogliceril-(4-amino)-benzoát: Rf 0,07; etil-(4-amino)-benzoát: Rf 0,55.
1. Cél és alkalmazási terület
Ez a módszer az alfa-monogliceril-(4-amino)-benzoátot határozza meg. Szintén meghatározza az etil-(4-amino)-benzoátot. Nem alkalmas 5% (m/m) feletti alfamonogliceril-(4-amino)-benzoát, illetve 1% (m/m) feletti etil-(4-amino)-benzoát meghatározására.
2. Fogalommeghatározás
Az ezzel a módszerrel meghatározott alfa-monogliceril-(4-amino)-benzoátot és etil-4-amino)-benzoátot a termék tömegszázalékában (% m/m) fejezzük ki.
3. Alapelv
A vizsgálati terméket metanolban szuszpendáljuk, majd a minta megfelelő kezelését követően nagynyomású folyadékkromatográfiával (HPLC) határozzuk meg.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak, továbbá ahol szükséges, HPLC-minőségűnek kell lennie
4.1. Metanol.
4.2. Kálium-dihidrogén-ortofoszfát (KH2PO4).
4.3. Cink-di(acetát) (Zn(CH3COO)2 · 2H2O).
4.4. Ecetsav
| (d | 20 ─ 4 | = 1,05). |
4.5. Tetrakálium-hexaciano-ferrát, (K4(Fe(CN)6) · 3H2O).
4.6. Etil-4-hidroxi-benzoát.
4.7. Alfa-monogliceril-(4-amino)-benzoát.
4.8. Etil-(4-amino)-benzoát.
4.9. Foszfát puffer oldat (0,02 M): oldjunk fel 2,72 g kálium-dihidrogén-ortofoszfátot (4.2.) egy liter vízben.
4.10. Oldószer: foszfát puffer oldat (4.9.)/metanol (4.1.) 61/39 (v/v).
A mozgó fázis összetétele változtatható annak érdekében, hogy az oszlop felbontása R ≥ 1,5 legyen.
| R = 2 | d'R2 – d'R1 ───── , W1 + W2 |
ahol:
R1 és R2 = a két csúcshoz tartozó retenciós idő, percben,
W1 és W2 = a csúcsoknak magasság felénél mért szélessége, milliméterben,
d' = a papíradagolás-sebessége, milliméter/percben.
4.11. Alfa-monogliceril-(4-amino)-benzoát törzsoldat: pontosan mérjünk be kb. 40 mg alfa-monogliceril-(4-amino)-benzoátot és tegyük be egy 100 ml-es mérőlombikba. Oldjuk fel 40 ml metanolban (4.1.). Töltsük fel a jelig a puffer oldattal (4.9.) és keverjük össze.
4.12. Etil-(4-amino)-benzoát törzsoldat: pontosan mérjünk be kb. 40 mg etil-(4-amino)-benzoátot és tegyük be egy 100 ml-es mérőlombikba. Oldjuk fel 40 ml metanolban (4.1.). Töltsük fel a jelig a puffer oldattal (4.9.) és keverjük össze.
4.13. Belső standard oldat: pontosan mérjünk be kb. 50 mg etil-4-hidroxibenzoátot (4.6.) és tegyük be egy 100 ml-es közönséges lombikba, oldjuk fel 40 ml metanolban (4.1.), töltsük fel a jelig a puffer oldattal (4.9.) és keverjük össze.
4.14. Standard oldatok: készítsünk négy standard oldatot 100 ml oldószerben (4.10.) való feloldással, a következő táblázat szerint:
| Alfa-monogliceril-(4-amino)- benzoát | Etil-(4-amino)-benzoát | Etil-4-hidroxibenzoát | |||||
| Standard oldat | (μg/ml) * | ml (4.11.) | (μg/ml) | ml (4.12.) | (μg/ml) | ml (4.13.) | |
| I | 8 | 2 | 8 | 2 | 50 | 10 | |
| II | 16 | 4 | 12 | 3 | 50 | 10 | |
| III | 24 | 6 | 16 | 4 | 50 | 10 | |
| IV | 40 | 10 | 20 | 5 | 50 | 10 | |
Megjegyzés: Ezeket az oldatokat más módon is el lehet készíteni.
4.15. Carrez I oldat: oldjunk fel 26,5 g tetrakálium-hexaciano-ferrátot (4.5.) vízben és töltsük fel 250 ml-re.
4.16. Carrez II oldat: oldjunk fel 54,9 g cink-di(acetátot) (4.3.) és 7,5 ml ecetsavat (4.4.) vízben és töltsük fel 250 ml-re.
4.17. Merck Lichrosorb RP-18, vagy annak megfelelő, 5 μm átlagos részecskemérettel.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Nagynyomású kromatográfiás berendezés változtatható hullámhosszú UV detektorral és hőszabályozós kamrakészlettel, 45 °C-ra beállítva.
5.3. Rozsdamentes acél oszlop: hossz: 250 mm; belső átmérő: 4,6 mm; töltet: Lichosorb RP – 18 (4.17.).
5.4. Ultrahangos fürdő.
6. Eljárás
6.1. Minta-előkészítés
6.1.1. Pontosan mérjünk be kb. 1 g mintát egy 100 ml-es főzőpohárba és adjunk hozzá 10 ml metanolt (4.1.).
6.1.2. Tegyük a főzőpoharat az ultrahangos fürdőbe (5.4.) 20 percre szuszpenzió elkészítése céljából. Tegyük át az így kapott szuszpenziót veszteségmentesen egy 100 ml-es mérőlombikba nem több mint 75 ml oldószerrel (4.10.).
Adjunk hozzá egymás után 1 ml Carrez I oldatot (4.15.) és 1 ml Carrez II oldatot (4.16.) és minden hozzáadás után keverjük össze. Töltsük fel jelig az oldószerrel (4.10.), keverjük újra össze és szűrjük át egy redős szűrőpapíron.
6.1.3. Pipettával tegyünk 3,0 ml-t a szűrletből, amelyet a 6.1.2. szerint kaptunk és 5,0 ml-t a belső standard oldatból (4.13.) egy 50 ml-es mérő lombikba és keverjük össze. Majd töltsük fel jelig az oldószerrel (4.10.). Használjuk az így kapott oldatot a 6.2.-ben leírt kromatográfia elvégzéséhez.
6.2. Kromatográfia
6.2.1. Állítsuk be a mozgó fázis (4.10.) áramlási sebességét 1,2 ml/percre és állítsuk az oszlop hőmérsékletét 45 °C-ra.
6.2.2. Állítsuk be a detektort (5.2.) 274 nm-re.
6.2.3. fecskendezzünk be egy mikrofecskendővel 20 μl-t a (6.1.3.) szerinti oldatból a kromatográfba és mérjük le a csúcsok alatti területet. Legalább kétszer ismételjük meg a mérést.
6.3. Kalibrációs görbe
6.3.1. Fecskendezzünk be 20-20 μl-t minden egyes standard oldatból (4.14.) és mérjük meg a csúcsok alatti területet.
6.3.2. Minden koncentrációhoz számítsuk ki az alfa-monogliceril-(4-amino)-benzoát csúcs alatti területe és a belső standard csúcs alatti területe közötti arányt. Ábrázoljuk ezt az arányt az abszcisszán, míg az ordinátán a kapcsolódó tömegeket tüntessük fel.
6.3.3. Járjunk el hasonló módon az etil-4-hidroxibenzoát esetében is.
7. Számolás
7.1. Olvassuk le a tömegarányokat (RP1, RP2) a 6.3. szerint kapott kalibrációs görbéről, amelyek a 6.2.3. szerint számított csúcs alatti területek közötti arányoknak felelnek meg, ahol:
RP1 = az alfa-monogliceril-(4-amino)-benzoát tömege/az etil-4-hidroxibenzoát tömege,
RP2 = az etil-(4-amino)-benzoát tömege/az etil-4-hidroxibenzoát tömege.
7.2. Az így kapott tömegarányokból számítsuk ki az alfa-monogliceril-(4-amino)-benzoát és az etil-(4-amino)-benzoát tartalmat, mint tömegszázalékot (% m/m) a következő képlet segítségével:
| Rp% (m/m) alfa-monogliceril-(4-amino)-benzoát = Rp1 x | q ─ 6p | ||
| Rp% (m/m) etil-(4-amino)-benzoát = Rp2 x | q ─ 6p | ||
q = az etil-4-hidroxibenzoát (belső standard) bemért mennyisége, milligrammban, a 4.12. szerint,
p = a minta bemért mennyisége, grammban, a 6.1.1. szerint.
8. Megismételhetőség *
8.1. 5%-os (m/m) alfa-monogliceril-(4-amino)-benzoáttartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,25%-ot.
8.2. 1%-os (m/m) etil-(4-amino)-benzoáttartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés abszolút értéke nem haladhatja meg a 0,10%-ot.
9. Megjegyzések
9.1. A vizsgálat végrehajtása előtt ellenőrizzük, hogy a minta tartalmaz-e olyan anyagokat, amelyek a kromatogramon fedésben vannak a belső standard (etil-(4-amino)-benzoát) csúcsával.
9.2. Annak ellenőrzésére, hogy esetleges zavaró hatás nem áll-e fenn, ismételjük meg a meghatározást a metanol mozgó fázisbeli arányának 10%-os megváltoztatásával.
1. Cél és alkalmazási terület
Ez a módszer az aeroszolok kivételével bármely kozmetikai termékben jelen lévő klórbutanol (INN) meghatározására alkalmazható, legfeljebb 0,5%-os koncentráció esetén.
2. Fogalommeghatározás
Az ezzel a módszerrel meghatározott klórbutanol tartalmat a termék tömegszázalékában (% m/m) fejezzük ki.
3. Alapelv
A vizsgálati termék megfelelő kezelése után a meghatározást gázkromatográfiával végezzük 2,2,2-triklór-etanol belső standard mellett.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
4.1. Klórbutanol (1,1,1-triklór-2-metil-propán-2-ol).
4.2. 2,2,2-triklór-etanol.
4.3. Abszolút etanol.
4.4. Klórbutanol belső standard oldat: 0,025 g 100 ml etanolban (4.3.) (m/v).
4.5. 2,2,2-triklór-etanol standard oldat: 4 mg 100 ml etanolban (4.3.) (m/v).
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Gázkromatográf, elektron befogásos detektorral felszerelve, Ni 63.
6. Eljárás
6.1. Minta-előkészítés
Pontosan mérjünk be egy 0,1 és 0,3 g közötti mennyiséget a mintából. Tegyük egy 100 ml-es mérőlombikba. Oldjuk fel etanolban (4.3.), adjunk hozzá 1 ml-t a belső standard oldatból (4.5.) és töltsük fel a jelig etanollal (4.3.)
6.2. Gázkromatográfiás körülmények
6.2.1. A működési körülményeknek R ≥ 1,5 felbontást kell eredményezniük.
| R = 2 | d'R2 – d'R1 ───── , W1 + W2 |
ahol:
R1 és R2 = a csúcsokhoz tartozó retenciós idők, percben,
W1 és W2 = a csúcsoknak a magasság felénél mért szélessége, (milliméterben),
d' = a papíradagolás sebessége, milliméter/percben.
6.2.2. Példaként a következő működési körülmények biztosítják a kívánt felbontást:
| Oszlop | I. | II. | |
| Alapanyag | Üveg | Rozsdamentes acél | |
| Hossz | 1,80 m | 3 m | |
| Átmérő | 3 mm | 3 mm | |
| Álló fázis | 10% Carbowax 20 M TPA, 80–100-as mesh Gaschrom Q-n | 5% OV 17 80–100-as mesh WAW DMCS-en | |
| Kondicionálás | 2–3 nap 190 °C-on | ||
| Hőmérsékletek: | |||
| – fecskendő | 200 °C | 150 °C | |
| – oszlop | 150 °C | 100 °C | |
| – detektor | 200 °C | 150 °C | |
| Vivőgáz | Nitrogén | Argon/metán (95/5 v/v) | |
| Áramlási sebesség | 35 ml/perc | 35 ml/perc |
6.3. Standard görbe
Öt 100 ml-es mérőlombikba tegyünk 1 ml standard oldatot (4.5.) és rendre 0,2; 0,3; 0,4; 0,5 és 0,6 ml 4.4. szerinti oldatot, és töltsük fel a jelig etanollal (4.3.) majd keverjük össze. Fecskendezzünk be 1 μl-t ezeknek az oldatoknak mindegyikéből a kromatográfba a 6.2.2. pont szerint leírt működési körülményeknek megfelelően és szerkesszük meg a kalibrációs görbét úgy, hogy a klórbutanol tömege és a 2,2,2-triklór-etanol tömege közötti arányt az abszcisszán, míg az a megfelelő csúcs alatti területeket az ordinátán tüntetjük fel.
6.4. Fecskendezzünk be 1 μl-t a 6.1. szerint kapott oldatból és járjunk el a 6.2.2.-ben leírtaknak megfelelően.
7. Számolás
7.1. Számítsuk ki az „a” mennyiséget a standard görbe (6.3.) alapján a 6.1. oldatban, a klórbutanol μg-jaiban kifejezve.
7.2. A minta klórbutanol tartalmát a következő képlet szerint számíthatjuk ki:
| % klórbutanol (m/m) = | a x 102 ─── p x 106 | = | a ─── p x 104 |
ahol: p = 6.1.1. pont szerinti bemérés g-ban
8. Megismételhetőség *
0,5%-os (m/m) klórbutanol-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,01%-ot.
Megjegyzés
Ha az eredmény eléri vagy meghaladja a megengedett legnagyobb koncentrációt, akkor ellenőrizni kell az esetleges zavaró hatásokat.
1. Cél és alkalmazási terület
Ez a módszer a kinin samponokban és hajszeszekben való jelenlétének kimutatására szolgál.
2. Alapelv
Az azonosítás vékonyréteg kromatográfiával szilikagélen történik. A kimutatást a kinin savas körülmények között adott kék fluoreszcenciája által végezzük 360 nm-en.
További bizonyításképpen a fluoreszcenciát meg lehet szüntetni brómgőzzel és ammóniagőz segítségével sárgás fluoreszcencia megjelenését előidézni.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Szilikagél lapok, fluoreszcens indikátor nélkül, 0,25 mm vastag, 200 mm x 200 mm.
3.2. Futtató oldat: toluol/dietil-éter/diklór-metán/dietil-amin/20/20/20/8 (v/v/v/v).
3.3 Metanol.
3.4. Kénsav
| (96%; d | 20 ─ 4 | = 1,84). |
3.5. Dietil-éter.
3.6. Előhívószer: óvatosan adjunk 5 ml kénsavat (3.4.) 95 ml dietil-éterhez (3.5.) egy hűtött tartályban.
3.7. Bróm.
3.8. Ammónium-hidroxid oldat
| (28%; d | 20 ─ 4 | = 0,90). |
3.9. Vízmentes kinin.
3.10. Standard oldat: pontosan mérjünk be kb. 100,0 mg vízmentes kinint (3.9.) egy közönséges lombikba és oldjuk fel 100 ml metanolban (3.3.).
4. Eszközök
4.1. Általános vékonyréteg kromatográfiás felszerelés.
4.2. Ultrahangos fürdő.
4.3. Millipore szűrő FH 0,5 fm vagy azzal megegyező, megfelelő szűrőberendezéssel.
5. Eljárás
5.1. Minta-előkészítés
Pontosan mérjünk be a mintából akkora mennyiséget, amely kb. 100 mg kinint tartalmaz egy 100 ml-es mérőlombikba, oldjuk fel és töltsük fel a jelig metanollal (3.3.).
Zárjuk le a lombikot dugóval és hagyjuk egy órára szobahőmérsékleten az ultrahangos készülékben (4.2.). Szűrjük le (4.3.) és a szűrletből végezzük el a kromatográfia meghatározást.
5.2. Vékonyréteg kromatográfia
Cseppentsünk fel 1,0 μl-t a standard oldatból (3.10.) és 1,0 μl-t a mintaoldatból (5.1.) a szilikagél lapra (3.1.). Futtassuk fel a kromatogramot 150 mm-es távolságra futtató kádban, amelyet előzőleg a 3.2. oldószerrel telítettünk.
5.3. Előhívás
5.3.1. Szárítsuk meg a lapot szobahőmérsékleten.
5.3.2. Permetezzük be a 3.6. reagenssel.
5.3.3. Hagyjuk a lapot száradni egy órán keresztül szobahőmérsékleten.
5.3.4. Figyeljük meg a lapot 360 nm-es UV lámpa fényében. A kinin élénk, kék fluoreszcens folt formájában jelenik meg.
Példaként az alábbi táblázat megadja a fő alkaloidák a kininhez viszonyítva RF értékeit a 3.2. oldószerrel való előhívás esetén:
| Alkaloida | RF | |
| Kinin | 0,20 | |
| Kinidin | 0,29 | |
| Cinkonin | 0,33 | |
| Cinkonidin | 0,27 | |
| Hidrokinidin | 0,17 |
5.3.5. A kinin jelenlétének további igazolása céljából a lapot kb. egy órán keresztül brómgőz hatásának tesszük ki (3.7.). A fluoreszcencia eltűnik. Ha ugyanezt a lapot ammóniagőz (3.8.) alá helyezzük, akkor a foltok ismét megjelennek barna színnel és a lap ismételt 360 nm-es UV fény alatti megfigyelése esetén sárgás fluoreszcencia tapasztalható.
Érzékelési határérték: 0,1 μg kinin.
1. Cél és alkalmazási terület
Ez a módszer a kinin meghatározását írja le. Alkalmas a samponokban megengedett 0,5% (m/m) és a hajszeszekben megengedett 0,2% (m/m) legnagyobb koncentráció meghatározására.
2. Fogalommeghatározás
Az ezzel a módszerrel meghatározott kinint a termék tömegszázalékában (% m/m) fejezzük ki.
3. Alapelv
A vizsgálandó termék megfelelő kezelését követően a meghatározást nagynyomású folyadékkromatográfiával (HPLC) végezzük.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak és emellett alkalmasnak kell lennie folyadékkromatográfiára is.
4.1. Acetonitril.
4.2. Kálium-dihidrogén-ortofoszfát (KH2PO4).
4.3. Ortofoszforsav
| (85%; d | 20 ─ 4 | = 1,7). |
4.4. Tetrametil-alumínium-bromid.
4.5. Vízmentes kinin.
4.6. Metanol.
4.7. Ortofoszforsav oldat (0,1 M): mérjünk be 11,53 g ortofoszforsavat (4.3.) és oldjuk fel 1000 ml vízben egy mérőlombikban.
4.8. Kálium-dihidrogén-ortofoszfát oldat (0,1 M): mérjünk be 13,6 g kálium-dihidrogén-ortofoszfátot (4.2.) és oldjuk fel 1000 ml vízben egy mérőlombikban.
4.9. Tetrametil-ammónium-bromid oldat: oldjunk fel 15,40 g tetrametil-ammónium-bromidot (4.4.) 1000 ml vízben egy mérőlombikban.
4.10. Oldószer: ortofoszforsav (4.7.)/kálium-dihidrogén-foszfát (4.8.)/tetrametil-ammóniumbromid (4.9.)/víz/acetonitril (4.1.) 10/50/100/340/90 (v/v/v/v/v).
A mozgó fázis összetétele változtatható olyan módon, hogy az oszlop felbontása R ≥ 1,5-t eredményezzen.
| R = 2 | d'R2 – d'R1 ───── W1 + W2 |
ahol:
R1 és R2 = a csúcsokhoz tartozó retenciós idők, percben,
W1 és W2 = a csúcsoknak a magasság felénél mért szélessége, milliméterben,
d' = a papíradagolás-sebessége, milliméter/percben.
4.11. Oktadecil-szilánnal kezelt szilikagél, 10 mm szemcsenagyság
4.12. Standard oldatok: mérjünk be egymás után pontosan kb. 5,0, 10,0, 15,0 és 20,0 mg vízmentes kinint (4.5.) egy sorozat 100 ml-es mérőlombikba. Töltsük fel a jelig metanollal (4.6.) és rázzuk a lombikok tartalmát addig, amíg a kinin fel nem oldódik. Szűrjük át mindegyik mintát 0,5 μm-es szűrőn.
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés.
5.2. Ultrahangos fürdő.
5.3. Nagynyomású kromatográfiás berendezés változtatható hullámhosszú detektorral.
5.4. Oszlop: hossz: 250 mm; belső átmérő: 4,6 mm; töltet: szilika (4.11.).
5.5. Millipore szűrő FH 0,5 μm vagy azzal megegyező, megfelelő szűrőberendezéssel.
6. Eljárás
6.1. Minta-előkészítés
Pontosan mérjünk be egy 100 ml-es lombikba megfelelő mennyiséget a mintából, amely 10,0 mg vízmentes kinint tartalmaz és adjunk hozzá 20 ml metanolt (4.6.), majd tegyük a lombikot az ultrahangos fürdőbe (5.2.) 20 percre. Töltsük fel jelig metanollal (4.6.). Keverjük össze az oldatot és szűrjük le egy részletét (5.5.).
6.2. Kromatográfia
Áramlási sebesség: 1,0 ml/perc.
Detektor hullámhossz (5.3.): 332 nm.
Befecskendezési térfogat: 10 μl szűrt oldat (6.1.)
Mérés: csúcs alatti terület.
6.3. Kalibrációs görbe
Fecskendezzünk be legalább háromszor egymás után 10,0 μl-t minden egyes referenciaoldatból (4.12.), mérjük meg a csúcs alatti területeket és számítsuk ki az átlagos területet minden egyes koncentráció esetében.
Készítsük el a kalibrációs görbét és ellenőrizzük a linearitást.
7. Számolás
7.1. Határozzuk meg a vízmentes kinin mennyiségét μg-ban, a befecskendezett térfogatra vonatkoztatva (6.2.) a kalibrációs görbe alapján (6.3.).
7.2. A vízmentes kinin tömegszázalékban (% m/m) kifejezett koncentrációja a mintában a következő képlet segítségével számítható ki:
| % (m/m) vízmentes kinin = | B ─ A | , |
ahol
B a vízmentes kinin mennyisége μg-ban, amit 10 mikroliter leszűrt oldat tartalmaz (6.1.).
A a minta tömege, grammban (6.1.).
8. Megismételhetőség *
0,5%-os (m/m) vízmentes kinintartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,02%-ot.
0,2%-os (m/m) vízmentes kinintartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,01%-ot.
Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben található szervetlen szulfitok és hidrogénszulfitok azonosítását és meghatározását írja le. Ez a módszer csak olyan termékek esetében alkalmazható, amelyekben van vizes vagy alkoholos fázis és amelyekben a kéndioxid koncentrációja nem haladja meg a 0,2%-ot.
1. Alapelv
A mintát sósavban melegítjük és a felszabaduló kén-dioxidot a szaga vagy az indikátorpapíron jelentkező hatása alapján azonosítjuk.
2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
2.1. Sósav (4 M).
2.2. Kálium-jodát keményítős papír vagy annak megfelelő más megoldás.
3. Eszközök
3.1. Általános vékonyréteg kromatográfiás felszerelés.
3.2. Lombik (25 ml) rövid visszafolyós hűtővel felszerelve.
4. Eljárás
4.1. Tegyünk kb. 2,5 g mintát a lombikba (3.2.) 10 ml sósavval (2.1.).
4.2. Keverjük össze és forraljuk fel.
4.3. Vizsgáljuk meg a kén-dioxid kibocsátását szag alapján vagy indikátorpapír segítségével (2.2.).
1. Fogalommeghatározás
A mintának ezzel a módszerrel meghatározott szulfit vagy hidrogén-szulfit tartalmát a kén-dioxid tömegszázalékában fejezzük ki.
2. Alapelv
A minta savanyítása után a felszabaduló kén-dioxidot hidrogén-peroxid oldatba desztilláljuk. A képződő kénsavat hitelesített nátrium-hidroxid oldattal titráljuk.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Hidrogén-peroxid 0,2% (m/v). Naponta készítsük.
3.2. Ortofoszforsav
| (d | 20 ─ 4 | = 1,75). |
3.3. Metanol.
3.4. Nátrium-hidroxid, (0,01 M) hitelesített oldat.
3.5. Nitrogén.
3.6. Indikátor: metilvörös (0,03%-os m/v etanolban) és metilénkék (0,05%-os m/v etanolban) 1:1 arányú keveréke. Szűrjük le az oldatot.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés.
4.2. Desztilláló felszerelés (lásd ábra).
5. Eljárás
5.1. Pontosan mérjünk be kb. 2,5 g mintát az A desztilláló lombikba (lásd ábra).
5.2. Adjunk hozzá 60 ml vizet és 50 ml metanolt (3.3.), majd keverjük össze.
5.3. Tegyünk 10 ml hidrogén peroxidot (3.1.), 60 ml vizet és egy pár csepp indikátort (3.6.) a desztilláló D gyűjtőedényébe (lásd ábra). Adjunk hozzá néhány csepp nátrium-hidroxidot (3.4.), amíg az indikátor zöld színűvé nem válik.
5.4. Ismételjük meg az 5.3.-t az E mosóüvegre (lásd ábra).
5.5. Szereljük össze a készüléket és állítsuk be a nitrogén (3.5.) áramlási sebességét kb. 60 buborék/perc.
5.6. Eresszünk 15 ml ortofoszforsavat (3.2.) a tölcsérből az A desztilláló lombikba.
5.7. Melegítsük fel gyorsan forrásig majd tartsuk enyhe forrásban 30 percig.
5.8. Válasszuk le a desztilláló D gyűjtőjét. Öblítsük át a csövet, majd titráljuk nátrium-hidroxid oldattal (3.4.), amíg az indikátor zöld színűvé nem válik (3.6.).
6. Számítás
Számítsuk ki a minta tömegszázalékos szulfit vagy hidrogén-szulfit tartalmát a következő képlet segítségével:
| % m/m kén-dioxid = | 3,2 MV ───m | , |
ahol:
M = a nátrium-hidroxid oldat (3.4.) moláris koncentrációja,
V = a nátrium-hidroxid oldat (3.4.) térfogata, amire a titrálás (5.8.) során szükség volt, milliliterben,
M = a minta (5.1.) tömege grammban.
7. Ismételhetőség *
0,2%-os m/m kén-dioxid-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,006%-ot.
Tanner szerinti kén-dioxid desztilláló berendezés
Minden méret mm-ben van megadva
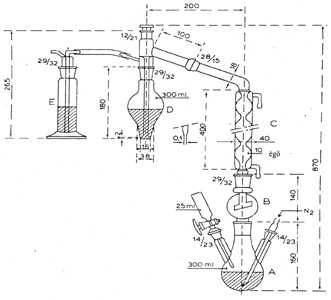
Cél és alkalmazási terület
A módszer leírja a klorátok azonosítását és meghatározását fogkrémekben és más kozmetikai termékekben.
1. Alapelv
A klorátokat vékonyréteg kromatográfiával elválasztjuk a többi halogenáttól, és a jodid jóddá oxidálásával azonosítjuk.
2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
2.1. Referenciaoldatok: frissen készített kálium-klorát, -bromát és -jodát vizes oldata (0,2% m/v).
2.2. Futtató oldat: ammónia oldat (28% m/v) aceton/butanol (60/130/30 v/v/v).
2.3. Kálium-jodid, vizes oldat (5% m/v).
2.4. Keményítőoldat (1–5%-os m/v).
2.5. Sósav (1 M).
2.6. Készgyártmány cellulóz vékonyréteg lapok (0,25 mm).
3. Eszközök
Általános vékonyréteg kromatográfiás felszerelés.
4. Eljárás
4.1. Vonjunk ki kb. 1 g-ot a mintából vízzel, szűrjük le és hígítsuk fel kb. 25 ml-re.
4.2. Vigyünk fel a lapra (2.6.) az oldatból (4.1.) 2 μl-t, a három referenciaoldat (2.1.) mindegyikének 2 μl-es részleteivel együtt.
4.3. Tegyük a lapot futtatókádba és futtassuk a kromatogramot a lap (2.6.) hosszának kb. háromnegyedéig a 2.2. pont szerinti oldószerrel.
4.4. Vegyük ki a tartályból és hagyjuk, hogy az oldószer elpárologjon. (NB: Ez akár két órát is igénybe vehet.)
4.5. Permetezzük be a lapot kálium-jodiddal (2.3.) és hagyjuk száradni kb. 5 percig.
4.6. Permetezzük be a lapot keményítő oldattal (2.4.) és hagyjuk száradni kb. 5 percig.
4.7. Permetezzük be a lapot sósavval (2.5.).
5. Értékelés
Ha a klorát van jelen, akkor egy kék folt (esetleg barna folt) jelenik meg fél óra múltán kb. 0,7–0,8 RF értéknél.
| Halogenátok | RF | |
| Jodát | 0–0,2 | |
| Bromát | 0,5–0,6 | |
| Klorát | 0,7–0,8 |
Meg kell jegyezni, hogy a bromátok és a jodátok azonnali reakciót adnak. Vigyázni kell, hogy a bromátok és a jodátok foltjai ne keveredjenek össze.
1. Fogalommeghatározás
A minta ezzel a módszerrel meghatározott klorát tartalmát a klorát tömegszázalékában fejezzük ki.
2. Alapelv
A klorátot savas körülmények között cinkporral redukáljuk. A képződő kloridot potenciometriás titrálással mérjük ezüst-nitrát oldat segítségével. Redukció előtt a halogenátok esetleges jelenlétét egy hasonló meghatározás lehetővé teszi.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Ecetsav, 80% (m/m).
3.2. Cinkpor.
3.3. Ezüst-nitrát standard oldat (0,1 M).
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés.
4.2. Potenciométer ezüst jelzésére alkalmas elektróddal felszerelve.
5. Eljárás
5.1. Minta-előkészítés
Pontosan mérjünk be kb. 2 g tömegű „m” mennyiséget egy centrifugacsőbe. Adjunk hozzá 15 ml ecetsavat (3.1.) és alaposan keverjük össze. Várjunk 30 percet és centrifugáljuk 15 percig 2000 fordulat/perc sebességgel. Tegyük át a felülúszó folyadékot egy 50 ml-es mérőlombikba. Ismételjük meg a centrifugálást kétszer, a maradékhoz 15 ml ecetsav hozzáadásával (3.1.). Gyűjtsük össze a klorátot tartalmazó oldatokat ugyanabba a mérőlombikba és töltsük fel a jelig ecetsavval (3.1.).
5.2. A klorát redukciója
Vegyünk 20 ml-t az 5.1. szerinti oldatból és adjunk hozzá 0,6 g cinkport (3.2.). Forraljuk fel egy visszafolyós hűtővel felszerelt lombikban. 30 perc forralás után hűtsük le és szűrjük le. Öblítsük át a lombikot vízzel. Szűrjük le és egyesítsük a szűrletet a kiöblítettel.
5.3. A klorid mennyiségi meghatározása
Titráljunk meg 20 ml 5.2. oldatot ezüst-nitráttal (3.3.) potenciométer alkalmazása mellett (4.2.). Hasonló módon titráljunk meg 20 ml 5.1. oldatot ezüst-nitráttal (3.3.).
Megjegyzés: Ha a termék bróm vagy jódszármazékokat tartalmaz, amelyekből bromid, illetve jodid szabadulhat fel a redukció után, akkor a titrálási görbe több inflexiós pontot fog tartalmazni. Ebben az esetben a titráló oldat (3.3.) térfogatát, ami a kloridnak felel meg, az utolsó és az utolsó előtti inflexiós pont közötti különbség adja.
6. Számítás
A minta tömegszázalékos (% m/m) klorát tartalmát a következő képlet segítségével számíthatjuk ki:
| Klorát (ClO3–)%m/m = | 20,9(V – V’)M ─────── m | , |
ahol:
V = az 5.2. szerinti oldat titrálásához felhasznált ezüst-nitrát oldat (3.3.) térfogata milliliterben,
V’ = az 5.1. szerinti oldat 20 ml-ének titrálásához felhasznált ezüst-nitrát oldat (3.3.) térfogata milliliterben,
M = az ezüst-nitrát oldat (3.3.) molaritása,
m = a minta tömege grammban.
7. Ismételhetőség *
3–5%-os m/m kloráttartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,07%-ot m/m.
Cél és alkalmazási terület
Ez a módszer nátrium-jodátot tartalmazó kozmetikai termékek lemosóinak azonosítására és mennyiségi meghatározására vonatkozó eljárást írja le.
1. Alapelv
A nátrium-jodátot elválasztjuk a többi halogenáttól vékonyréteg kromatográfiával, és a jodid jóddá oxidálásával azonosítjuk.
2. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
2.1. Referenciaoldatok: frissen készített kálium-klorát, -bromát és -jodát vizes oldata (0,01% m/v).
2.2. Előhívó oldat: ammónia oldat (28% m/v)/aceton/butanol (60/130/30 v/v/v).
2.3 Kálium-jodid, vizes oldat (5% m/v).
2.4. Keményítőoldat (1–5%-os m/v).
2.5. Sósav (1 M).
3. Eszközök
3.1. Készgyártmány cellulóz vékonyréteg lapok (0,25 mm).
3.2. Általános vékonyréteg kromatográfiás felszerelés.
4. Eljárás
4.1. Vonjunk ki kb. 1 g-ot a mintából vízzel, szűrjük le és hígítsuk fel kb. 10 ml-re.
4.2. Vigyünk fel a mintából 2 μl-t a lap alapvonalára (3.1.), a három referenciaoldat (2.1.) mindegyikének 2 μl-es részleteivel együtt.
4.3. Tegyük a lapot futtató kádba és futtassuk fel a kromatogramot a lap (2.6.) hosszának kb. háromnegyedéig a (2.2.) szerinti oldószerrel.
4.4. A lap kivétele után hagyjuk, hogy az oldószer szobahőmérsékleten elpárologjon.
(Megjegyzés: Ez akár két órát is igénybe vehet.)
4.5. Permetezzük be a lapot kálium-jodiddal (2.3.) és hagyjuk száradni kb. 5 percig.
4.6. Permetezzük be a lapot keményítő oldattal (2.4.) és hagyjuk száradni kb. 5 percig.
4.7. Végül permetezzük be a lapot sósavval (2.5.).
5. Értékelés
Ha a jodát jelen van, akkor egy kék folt (esetleg barna vagy állás közben megbarnuló folt) jelenik meg azonnal kb. 0–0,2 RF értéknél.
Meg kell jegyezni, hogy a bromátok azonnali reakciót adnak kb. 0,5–0,6 RF értéknél, és a klorátok kb. 30 perc múltán ugyancsak adnak reakciót 0,7–0,8 RF értéknél.
1. Fogalommeghatározás
Az ezzel a módszerrel meghatározott nátrium-jodát tartalmat a nátrium-jodát tömegszázalékában fejezzük ki.
2. Alapelv
A nátrium-jodátot vízben feloldjuk és nagynyomású folyadékkromatográfiával (HPLC) határozzuk meg, egy C18 oszlop és egy anioncserélő oszlop alkalmazásával.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak és nagynyomású folyadékkromatográfiára alkalmasnak kell lennie.
3.1. Sósav (4 M).
3.2. Nátrium-szulfit vizes, 5% m/v.
3.3. Nátrium-jodát törzsoldat.
Készítsünk törzsoldatot, amely 50 mg nátrium-jodátot tartalmaz 100 ml vízben.
3.4. Kálium-dihidrogén-ortofoszfát.
3.5. Dinátrium-hidrogén-ortofoszfát 2H2O.
3.6. Nagynyomású folyadékkromatográfia mozgó fázisa: oldjunk fel 3,88 g kálium-dihidrogén-ortofoszfátot (3.4.) és 1,19 g dinátrium-hidrogén-ortofoszfátot 2H2O-t (3.5.) 1 liter vízben. A kapott oldat pH-ja 6,2 legyen.
3.7. Általános indikátorpapír, 1–11 pH tartományú.
4. Eszközök
Szokásos laboratóriumi felszerelés.
4.1. Kerek szűrőpapír, 110 mm-es átmérőjű, Scleicher és Schüll 575-ös számú vagy azzal megegyező.
4.2. Nagynyomású folyadékkromatográf változtatható hullámhosszú detektorral.
4.3. Oszlop: hossz: 120 mm, belső átmérő 4,6 mm; szám: kettő, sorba kötve, az első oszlop: necleosil R 5 C18 vagy azzal megegyező, második oszlop – Vydac TM-301-SB vagy azzal megegyező.
5. Eljárás
5.1. Minta-előkészítés
5.1.1. Folyékony minták (samponok)
Pontosan mérjünk be kb. 1,0 g vizsgálati mintát egy 10 ml-es csiszolt üvegdugós kalibrált csőbe vagy mérőlombikba. Töltsük fel a jelig vízzel és keverjük össze.
Szükség esetén szűrjük le az oldatot. Határozzuk meg az oldat jodát tartalmát HPLC-vel az 5.2. szakaszban leírtak szerint.
5.1.2. Szilárd minták (szappanok)
Vágjuk apróra a minta egy részét és pontosan mérjünk be kb. 1,0 g vizsgálati mintát egy 100 ml-es csiszolt üvegdugós edénybe. Töltsük fel 50 ml-re vízzel és rázzuk erősen 1 percig. Centrifugáljuk le és szűrjük át szűrőpapíron (4.1.) vagy hagyjuk a keveréket legalább egy éjszakán át állni. Rázzuk meg erősen a kocsonyás oldatot és szűrjük át szűrőpapíron (4.1.). Határozzuk meg az oldat jodát tartalmát HPLC-vel az 5.2. szakaszban leírtak szerint.
5.2. Kromatográfia
Áramlási sebesség: 1 ml/perc.
Detektor hullámhossz (4.2.): 210 nm.
Befecskendezési térfogat: 10 μl.
Mérés: csúcs alatti terület.
5.3. Kalibrálás
Pipettázzunk sorrendben 1,0, 2,0, 5,0, 10,0 és 20,0 ml nátrium jodát törzsoldatot (3.3.) 50 ml-es mérőlombikokba. Jelig töltsük fel és keverjük össze.
Az így kapott oldatok rendre 0,01, 0,02, 0,05, 0,10 és 0,20 mg nátrium-jodátot tartalmaznak milliliterenként.
Fecskendezzünk be egy 10 μl-es részletet minden egyes standard jodát oldatból a folyadékkromatográfba (4.2.) és vegyük fel a kromatogramot. Határozzuk meg a jodát csúcs alatti területét és rajzoljunk fel egy görbét, ami megadja az összefüggést a csúcs alatti terület és a nátrium-jodát koncentráció között.
6. Számítás
Számítsuk ki a nátrium-jodát tartalmat tömegszázalékban (% m/m) a következő képlet segítségével:
| % (m/m) nátrium-jodát = | Vc ── 10 m | , |
ahol:
m = a vizsgálati minta (5.1.) tömege, grammban,
V = a mintaoldat teljes térfogata, milliliterben, az 5.1. pont szerint előállítva,
C = a nátrium-jodátnak a kalibrációs görbéről (5.3.) leolvasott koncentrációja milligramm per milliliterben.
7. Ismételhetőség *
0,1%-os (m/m) nátrium-jodát-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,002%-ot.
8. Megerősítés
8.1. Alapelv
Egy kozmetikai termék savanyított oldatában, a jodátot (IO3–) szulfittal jodiddá (I–) redukáljuk és a kapott oldatot HPLC-vel vizsgáljuk. Ha egy csúcs, amely a jodátnak megfelelő retenciós időnél jelentkezik, a szulfitos kezelés után eltűnik, akkor az eredeti csúcsot nagy valószínűséggel a jodátnak tulajdoníthatjuk.
8.2. Eljárás
Pipettázzunk egy 5 ml-es adagot az 5.1.-ben leírtak szerint kapott mintaoldatból egy Erlenmeyer lombikba.
Állítsuk az oldat pH értékét 3-ra vagy alacsonyabbra sósavval (3.1.); általános indikátor papír ellenőrizzük (3.7.).
Adjunk hozzá három csepp nátrium-szulfit oldatot (3.2.) és keverjük össze.
Fecskendezzünk be egy 10 μl-es részletet az oldatból a folyadékkromatográfba (4.2.).
Hasonlítsuk össze ezt a kromatogramot az 5 pontban megadottak szerint ugyanarra a mintára kapott kromatogrammal.
(A 85/490/EGK irányelv alapján)
1. Cél és alkalmazási terület
Ez a módszer a vizes kozmetikai termékekben lévő ezüst-nitrát ezüstként történő azonosítását írja le.
2. Fogalommeghatározás
Az ezüstöt klorid ionokkal képzett, jellemző fehér csapadékként azonosítjuk.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. 2 M-os sósav oldat,
3.2. Ammónia oldat: hígítsunk koncentrált ammónium-hidroxid oldatot (d20 = 0,88 g/ml) azonos mennyiségű vízzel és keverjük össze.
3.3. 2 M-os salétromsav oldat.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés.
4.2. Centrifuga.
5. Eljárás
5.1. Mintegy 1 g-nyi centrifugacsőben lévő mintához adjunk cseppenként 2 M-os sósav oldatot (3.1.), amíg a csapadékképződés befejeződik; keverjük meg és centrifugáljuk le.
5.2. Öntsük le a felülúszó folyadékot, és egyszer mossuk ki a csapadékot öt csepp hideg vízzel. Öntsük le a mosófolyadékot.
5.3. Adjunk a centrifugacsőben lévő csapadékhoz azonos mennyiségű vizet. Melegítsük felforrásig és keverjük meg.
5.4. Forrón centrifugáljuk le; majd öntsük le a felülúszó folyadékot.
5.5. Adjunk a csapadékhoz néhány csepp ammónia oldatot (3.2.); keverjük meg és centrifugáljuk le.
5.6. A felülúszó folyadék egy cseppjéhez adjunk néhány csepp 2 M-os salétromsav oldatot (3.3.) egy üveglemezen.
5.7. Fehér csapadék ezüst jelenlétét jelzi.
1. Cél és alkalmazási terület
Ez a módszer a szempillafestéknek és szemöldökfestéknek szánt kozmetikai termékekben lévő ezüst-nitrát ezüstként történő meghatározására alkalmas.
2. Alapelv
Az ezüstöt a termékben atomabszorpciós spektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. 0,02 M-os salétromsav oldat.
3.2. Ezüst mérőoldatok.
3.2.1. Ezüst-nitrát törzsoldat, 1000 μg/ml-es, 0,5 M-os salétromsav oldatban („SpectrosoL” vagy azzal megegyező)
3.2.2. Ezüst mérőoldat, 100 μg/ml-es; pipettával töltsünk 10 ml törzsoldatot (3.2.1.) egy 100 ml-es mérőlombikba. Töltsük fel jelig 0,02 M-os salétromsav oldattal (3.1.) és keverjük meg. Ezt a mérőoldatot frissen kell készíteni, és sötétszínű üvegben kell tárolni.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. Ezüst vájtkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1. Minta-előkészítés
Mérjünk ki pontosan mintegy 0,1 g (m gramm) homogén mintát a termékből. Veszteség nélkül töltsük át egy 1 literes mérőlombikba és töltsük fel a jelig 0,02 M-os salétromsav oldattal (3.1.), majd keverjük meg.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: levegő-acetilén
Hullámhossz: 338.3 nm
Háttér korrekció: van
Fűtési körülmények: gyenge; a legnagyobb abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1 Egy sorozat 100 ml-es mérőlombikba pipettázzunk bele 1,0; 2,0; 3,0; 4,0 és 5,0 ml ezüst mérőoldatot (3.2.2.). Töltsük fel mindegyik lombikot a jelig 0,02 M-os salétromsav oldattal (3.1.) és keverjük meg. Ezek az oldatok 1,0; 2,0; 3,0, 4,0 és 5,0 μg ezüstöt tartalmaznak milliliterenként.
5.3.2. Mérjük meg egy 0,02 M-os salétromsav oldat (3.1.) abszorbanciáját, és a kapott értéket a kalibrációs görbe nulla ezüst koncentrációjaként használjuk. Mérjük meg mindegyik ezüst mérőoldat (5.3.1.) abszorbanciáját. Rajzoljuk meg a kalibrációs görbét, ábrázoljuk az abszorbancia értékeket az ezüst-koncentráció függvényében.
5.4. Meghatározás
Mérjük meg a mintaoldat (5.1.) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó ezüstkoncentrációt.
6. Számítás
Számítsuk ki a minta ezüst-nitrát tartalmát tömegszázalékban (% m/m) a következő képlet segítségével:
| ezüst – nitrát% (m/m) = | 1,5748 x c ──── 10 x m | , |
ahol:
m = a vizsgálathoz kivett minta (5.1) tömege grammban;
és
c = a mintaoldatban (5.1) lévő ezüstkoncentrációja mikrogramm/milliliterben, a kalibrációs görbe alapján.
7. Megismételhetőség *
4% (m/m) ezüst-nitrát tartalom esetén azonos mintán párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem lehet nagyobb mint 0,05% (m/m).
1. Cél és alkalmazási terület
Ez a módszer a szelén-diszulfid szelénként történő azonosítását írja le korpásodás elleni samponokban.
2. Alapelv
A szelént jellemző sárgás-narancssárga színe alapján azonosítjuk, amely karbamiddal és kálium-jodiddal való reakciója során alakul ki.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált salétromsav (d20 = 1,42 g/ml)
3.2. Karbamid
3.3. Kálium-jodid oldat, 10% (m/v)-os; oldjunk fel 10 g kálium-jodidot 100 ml vízben.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. Roncsoló cső, 100 ml-es
4.3. Blokkhevítős roncsoló
4.4. Szűrőpapír (Whatman 42. számú vagy ezzel egyenértékű) vagy egy 0,45 μm-es membránszűrő
5. Eljárás
5.1. Körülbelül 1 g, roncsoló csőben (4.2.) lévő samponhoz adjunk 2,5 ml koncentrált salétromsavat (3.1.) és roncsoljuk 150 °C-on 30 percig a blokkhevítős roncsolón (4.3.).
5.2. Hígítsuk vízzel 25 ml-re a roncsolt mintát és szűrjük át egy szűrőpapíron vagy egy 0.45 μm-es membránszűrőn (4.4.).
5.3. 2,5 ml szűrlethez adjunk 5 ml vizet, 2,5 g karbamidot (3.2.) és forraljuk fel. Hűtsük le és adjunk hozzá 1 ml kálium-jodid oldatot (3.3.).
5.4. A sárgás-narancssárga szín, ami állás közben gyorsan sötétedik, a szelén jelenlétét jelzi.
1. Cél és alkalmazási terület
Ez a módszer maximálisan 4,5% (m/m) szelén-diszulfid tartalmú, korpásodás elleni samponokban lévő szelén-diszulfid szelén formájában történő meghatározására alkalmas.
2. Alapelv
A mintát salétromsavval roncsoljuk, és az eredményül kapott digerátumban a szelént atomabszorpciós spektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált salétromsav (d20 = 1,42 g/ml)
3.2. Salétromsav oldat, 5%-os (v/v); adjunk 50 ml koncentrált salétromsavat (3.1.) 500 ml főzőpohárban lévő vízhez folyamatos keverés mellett. Töltsük át ezt az oldatot egy 1 literes mérőlombikba, és vízzel töltsük fel a jelig.
3.3. Szelén mérő törzsoldat, 1000 μg/ml-es, 0,5 M-os salétromsav oldatban („SpectrosoL” vagy ezzel egyenértékű)
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. Roncsoló cső, 100 ml-es
4.3. Blokkhevítős roncsoló
4.4. Szűrőpapír (Whatman 42-es vagy ezzel egyenértékű) vagy egy 0,45 μm-es membránszűrő
4.5. Szelén üregkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1 Minta-előkészítés
5.1.1. Mérjünk be pontosan kb. 0,1 g (m gramm) homogén samponmintát egy roncsoló csőbe (4.2.).
5.1.2. Adjunk hozzá 5 ml koncentrált salétromsavat (3.1.), és roncsoljuk 150 °C-on egy órán keresztül egy blokkhevítős roncsolón (4.3.).
5.1.3. Hagyjuk az oldatot lehűlni és hígítsuk fel vízzel 100 ml-re. Szűrjük át egy szűrőpapíron vagy egy 0.45 μm-es membránszűrőn (4.4.), és tartsuk meg a szűrt oldatot a mennyiségi meghatározáshoz.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: levegő-acetilén
Hullámhossz: 196,0 nm
Háttér korrekció: van
Fűtési körülmények: gyenge; a legnagyobb abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1. Egy 100 ml-es mérőlombik sorozatba pipettázzunk be 1,0; 2,0; 3,0; 4,0 és 5,0 ml szelén mérő törzsoldatot (3.3.). Töltsük fel mindegyik lombikot a jelig 5%-os (v/v) salétromsav oldattal (3.1.) és keverjük meg. Ezek az oldatok 10, 20, 30, 40 és 50 μg szelént tartalmaznak milliliterenként.
5.3.2. Mérjük meg egy 5%-os (v/v) salétromsav oldat (3.2.) abszorbanciáját és a kapott értéket a kalibrációs görbe nulla szelén koncentrációjaként használjuk. Mérjük meg mindegyik szelén kalibráló mérőoldat (5.3.1.) abszorbanciáját. Rajzoljuk meg a kalibrációs görbét, ábrázoljuk az abszorbancia értékeket a szelén-koncentráció függvényében.
5.4. Mennyiségi meghatározás
Mérjük meg a mintaoldat (5.1.3) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó szelén-koncentrációt.
6. Számítás
Számítsuk ki a minta szelén-diszulfid tartalmát tömegszázalékban (% m/m) a következő képlet segítségével:
| szelén-diszulfid = | 1,812 x c ──── 100 x m | , |
ahol:
m = a vizsgálati minta (5.1.1) tömege grammban;
és
c = a mintaoldatban (5.1.3) lévő szelénkoncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján.
7. Megismételhetőség *
1% (m/m) szelén-diszulfid tartalom esetén azonos mintán, párhuzamos végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,05%-ot (m/m).
1. Cél és alkalmazási terület
Ez a módszer a pigmentekben lévő oldható bárium sók vagy lakkok formájában történő extrakciós eljárását és mennyiségi meghatározását írja le.
2. Alapelv
A pigmentet meghatározott körülmények között 0,07 M-os sósavval kivonjuk, és a kivonatban lévő bárium mennyiségét atomabszorpciós spektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Abszolút etil-alkohol
3.2. 0,07 M-os sósav oldat
3.3. 0,5 M-os sósav oldat
3.4. 8%-os (m/v) kálium-klorid oldat; oldjunk fel 16 g kálium-kloridot 200 ml 0,07 M-os sósav oldatban (3.2.).
3.5. Bárium mérőoldatok
3.5.1. Bárium mérő törzsoldat, 1000 μg/ml, 0,5 M-os salétromsav oldatban („SpectrosoL” vagy ezzel egyenértékű)
3.5.2. Bárium standard oldat, 200 μg/ml; pipettával töltsünk 20 ml bárium mérő törzsoldatot (3.5.1.) egy 100 ml-es mérőlombikba. Töltsük fel a jelig 0,07 M-os sósav oldattal (3.2.) és keverjük meg.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelések
4.2. pH-mérő, ±0,02 egység pontossággal
4.3. Körkörös rázógép
4.4. 0,45 μm-es pórusméretű membránszűrő
4.2. Bárium üregkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1. Minta-előkészítés
5.1.1. Mérjünk be pontosan kb. 0,5 g (m gramm) pigmentet egy Erlenmeyer lombikba. Azért, hogy a hatékony keveréshez elégséges térfogatot biztosítsunk, 150 ml-nél kisebb térfogatú lombik nem használható.
5.1.2. Pipettával adjunk hozzá 1,0 ml etil-alkoholt, és forgassuk a lombikot, hogy a festék nedvesítése alapos legyen. Egy bürettából adjunk hozzá pontosan olyan mennyiségű 0,07 M-os sósav oldatot (3.2.), amely pontosan 50 milliliter/gramm savtérfogat/pigmenttömeg arányt biztosít. Az etil-alkoholt tartalmazó kivonat teljes térfogata legyen „V” ml. Rázzuk össze a lombik tartalmát öt másodpercig, hogy a komponensek tökéletesen összekeveredjenek.
5.1.3. Egy pH-mérő (4.2.) segítségével mérjük meg a kapott szuszpenzió pH-ját, és ha az 1,5 felett van, adjunk hozzá cseppenként 0,5 M-os sósavat (3.3.) addig, amíg 1,4–1,5-ös tartományba be nem áll.
5.1.4. A lombikot dugóval zárjuk be, és rögtön kezdjük el rázni 60 percen keresztül egy körkörös rázógéppel (4.3.). A rázógépnek akkora sebességen kell működnie, hogy hab képződjön. Szűrjük át egy 0,45 μm-es membránszűrőn és gyűjtsük össze a szűrletet. Ne centrifugáljuk a kivonatot szűrés előtt. Pipettával töltsünk 5,0 ml szűrletet egy mérőlombikba; töltsük fel a jelig 0,07 M-os sósav oldattal (3.2.) és keverjük meg. Ezt az oldatot használjuk a stroncium (B. rész) meghatározására is.
5.1.5. Pipettával mérjünk be egy 100 ml-es mérőlombikba 5,0 ml kálium-klorid oldatot (3.4.) és a higított szűrletből (5.1.4.) egy várhatóan 3 és 10 μg bárium/milliliter közötti koncentrációnak megfelelő elkülönített részt (WBa ml). (Egy 10 ml-es részletnek elégnek kell lennie egy kezdőponthoz.) Töltsük fel 0,07 M-os sósav oldattal (3.2.) és keverjük meg.
5.1.6. Az oldat bárium koncentrációját (5.1.5.) atomabszorpciós spektrometriával határozzuk meg még ugyanazon a napon.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: nitrogénoxid-acetilén
Hullámhossz: 553,5 nm
Háttér korrekció: nincs
Fűtési körülmények: gyenge; a maximális abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1. Egy sorozat 100 ml-es mérőlombikba pipettázzunk be 1,0; 2,0; 3,0; 4,0 és 5,0 ml bárium mérőoldatot (3.5.2.). Mindegyik lombikba pipettázzunk be 5,0 ml kálium-klorid oldatot (3.4.); töltsük fel mindegyik lombikot a jelig 0,07 M sósav oldattal (3.2) és keverjük össze. Ezek az oldatok 2,0; 4,0; 6,0; 8,0 és 10,0 μg báriumot tartalmaznak milliliterenként.
Hasonlóképpen készítsünk egy vakoldatot, amiből hiányzik a bárium mérőoldat.
5.3.2. Mérjük meg a vakoldat (5.3.1.) abszorbanciáját és a kapott értéket a kalibrációs görbe nulla bárium koncentrációjaként használjuk. Mérjük meg mindegyik bárium mérőoldat (5.3.1.) abszorbanciáját. Rajzoljuk meg a kalibrációs görbét, ábrázoljuk az abszorbancia értékeket a bárium-koncentráció függvényében.
5.4. Mennyiségi meghatározás
Mérjük meg a mintaoldat (5.1.3.) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó bárium-koncentrációt.
6. Számítás
A pigment oldható bárium tartalmát (% m/m) a következő képlet adja meg:
| oldható bárium% (m/m) = | c x V ───── 10WBa x m | , |
ahol:
m = a vizsgálati minta (5.1.1.) tömege grammban;
c = a mintaoldatban (5.1.5.) lévő bárium-koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján;
V = a kivonat össztérfogata milliliterben (5.1.2.);
és
WBa = az 5.1.5. pontban kivett kivonat térfogata
7. Megismételhetőség
Ennek a módszernek a legjobb becsült megismételhetősége 0,3% (ISO 5725) 2%-os (m/m) oldható bárium tartalom esetén.
8. Megjegyzések
8.1. Bizonyos körülmények között a bárium abszorbanciája megnőhet kalcium jelenlétében.
Ez 5 g/l * magnézium-ion adagolásával ellensúlyozható.
8.2 Az atomabszorpciós lángspektrometria mellett megengedett az induktív kapcsolású plazma – emissziós optikai spektrometria használata.
1. Cél és alkalmazási terület
Ez a módszer a festékekben lévő oldható stroncium extrakciós eljárását és sók vagy lakkok formájában történő mennyiségi meghatározását írja le.
2. Alapelv
A mintát meghatározott körülmények között 0,07 M-os sósavval kivonjuk, és a kivonatban lévő stroncium mennyiségét atomabszorpciós spektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Abszolút etil-alkohol
3.2. 0,07 M-os sósav oldat
3.3. 8%-os (m/v) kálium-klorid oldat: oldjunk fel 16 g kálium-kloridot 200 ml 0,07 M-os sósav oldatban (3.2.).
3.4. Stroncium mérőoldatok
3.4.1. Stroncium mérő törzsoldat, 1000 μg/ml, 0,5 M-os salétromsav oldatban („SpectrosoL” vagy ezzel egyenértékű)
3.4.2. Stroncium mérőoldat, 100 μg/ml: pipettával töltsünk 10 ml stroncium mérő törzsoldatot (3.4.1.) egy 100 ml-es mérőlombikba. Töltsük fel a jelig 0,07 M-os sósav oldattal (3.2.) és keverjük össze.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. 0,45 μm-es pórusméretű membránszűrő
4.3. Stroncium vájtkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1. Minta-előkészítés
Az A.5.1.4. pontban elkészített oldatot használjuk az oldott stroncium tartalom mennyiségi meghatározására.
5.1.1. Pipettával mérjünk be egy 100 ml-es mérőlombikba 5,0 ml kálium-klorid oldatot (3.4.) és a higított szűrletből (A.5.1.4.) egy várhatóan 2 és 5 μg stroncium/ milliliter közötti koncentrációjú leválasztott részt (W ml). (Egy 25 ml-es részletnek elégnek kell lennie a kezdőponthoz). Töltsük fel 0,07 M sósav oldattal (3.2.) és keverjük össze.
5.1.2. Az oldat stroncium koncentrációját (5.1.5.) atomabszorpciós spektrometriával határozzuk meg még ugyanazon a napon.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: nitrogénoxid-acetilén
Hullámhossz: 460,7 nm
Háttér korrekció: nincs
Fűtési körülmények: gyenge; a legnagyobb abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1. Egy sorozat 100 ml-es mérőlombikba pipettázzunk be 1,0; 2,0; 3,0; 4,0 és 5,0 ml stroncium mérőoldatot (3.5.2.). Mindegyik lombikba pipettázzunk bele 5,0 ml kálium-klorid oldatot (3.3.); töltsük fel mindegyik lombikot a jelig 0,07 M sósav oldattal (3.2.) és keverjük meg. Ezek az oldatok 1,0, 2,0, 3,0, 4,0 és 5,0 μg stronciumot tartalmaznak milliliterenként.
Hasonlóképpen készítsünk vakpróba oldatot, amiből hiányzik a stroncium mérőoldat.
5.3.2. Mérjük meg egy vakpróba oldat (5.3.1.) abszorbanciáját, és a kapott értéket a kalibrációs görbe nulla stroncium koncentrációjaként használjuk. Mérjük meg mindegyik stroncium mérőoldat (5.3.1.) abszorbanciáját. Rajzoljuk meg a kalibrációs görbét, ábrázoljuk az abszorbancia értékeket a stroncium-koncentráció függvényében.
5.4. Mennyiségi meghatározás
Mérjük meg a mintaoldat (5.1.3.) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó stroncium-koncentrációt.
6. Számítás
A pigment oldható stroncium tartalmát (% m/m) a következő képlet adja meg:
| oldható stroncium% (m/m) = | c x v ──── 10WSr x m | , |
ahol:
m = a vizsgálathoz kivett minta (A.5.1.1.) tömege grammban;
c = a mintaoldatban (5.1.1.) lévő stroncium-koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján;
V = a kivonat térfogata milliliterben (A.5.1.2.);
és
WSr = az 5.1.1. pontban kivett kivonat térfogata
7. Megismételhetőség
Ennek a módszernek 0,09% a legjobb becsült megismételhetősége (ISO 5725) 0,6%-os (m/m) oldható stroncium tartalom esetén.
8. Megjegyzés
Az atomabszorpciós lángspektrometria mellett megengedett az induktív kapcsolású plazma – emissziós optikai spektrometria használata.
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben lévő benzil-alkohol azonosítását írja le.
2. Alapelv
A benzil-alkoholt szilikagél lemezeken végrehajtott vékonyréteg-kromatográfia segítségével azonosítjuk.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Benzil-alkohol
3.2. Kloroform
3.3. Abszolút etil-alkohol
3.4. n-Pentán
3.5. Futtató oldat: dietil-éter
3.6. Benzil-alkohol mérőoldat: mérjünk be 0,1 g benzil-alkoholt (3.1.) egy 100 ml-es mérőlombikba, töltsük fel jelig etil-alkohollal (3.3.) és keverjük össze.
3.7. Vékonyréteg kromátográfiás üveglemezek, 100 x 200 mm-es vagy 200 x 200 mm-es, 0,25 mm vastag szilikagél 60 F254 réteggel bevonva.
3.8. Előhívószer: 12-molibdén-foszforsav, 10% (m/v) etil-alkoholban (3.3.)
4. Eszközök
4.1. Normál vékonyréteg kromatográfiás készülék
4.2. Kromatográfiás kád, kétcsatornás kamrával, külső méretei kb. 80 mm x 230 mm x 240 mm
4.3. Kromatográfiás papír: Whatman vagy ezzel egyenértékű
4.4. Ultraibolya lámpa, hullámhossz 254 nm.
5. Eljárás
5.1. Minta-előkészítés
Mérjünk be 1,0 g-ot a vizsgálni kívánt termékből egy 10 ml-es mérőlombikba. Adjunk hozzá 3 ml kloroformot (3.2.) és rázzuk erősen addig, amíg a termék teljesen feloldódik. Töltsük fel jelig etil-alkohollal (3.3.) és rázzuk erősen addig, míg egy tiszta vagy csaknem tiszta oldatot kapunk.
5.2 Vékonyréteg kromatográfia
5.2.1. Töltsük fel a kromatográfiás kádat (4.2.) n-pentánnal (3.4.) a következőképpen: vonjuk be a hátsó csatorna melletti kamrafalat a kromatográfiás papírral (4.3.) biztosítva, hogy a papír alsó széle a csatornában legyen. Töltsünk 25 ml n-pentánt (3.4) a hátsó csatornába olyan módon, hogy a kromatográfiás papír exponált felületére öntjük az oldószert. Azonnal tegyük vissza a fedelet és hagyjuk a kádat állni 15 percig.
5.2.2. Vigyünk fel 10 μl mintaoldatot (5.1.) és 10 μl benzil-alkohol mérőoldatot (3.6.) a vékonyréteg kromatográfiás lemez (3.7.) alapvonalának megfelelő pontjaira. Hagyjuk megszáradni.
5.2.3. Pipettázzunk 10 ml dietil-étert (3.5.) a kád elején lévő csatornába, és közvetlenül ezután tegyük a lemezt (5.2.2.) ugyanebbe a csatornába. Gyorsan tegyük vissza a kád fedelét, és futtassuk a folyadékot a lemezen 150 mm távolságig. Vegyük ki a lemezt a kromatográfiás tartályból, és hagyjuk megszáradni szobahőmérsékleten.
5.2.4. Vizsgáljuk meg a lemezt (5.2.3.) ultraibolya lámpa alatt, és jelöljük be a lila foltokat. Permetezzük be a lemezt az előhívószerrel (3.8.), és azután melegítsük 120 °C-on mintegy 15 percen keresztül. A benzil-alkohol sötétkék foltként jelenik meg.
5.2.5. Számítsuk ki az Rf értéket, amit a benzil-alkohol mérőoldattal kapunk. Egy ugyanolyan Rf értékkel rendelkező, a mintaoldatból kapott sötétkék folt benzil-alkohol jelenlétét jelzi.
Detektálási határérték: 0,1 μg benzil-alkohol.
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben lévő benzil-alkohol meghatározását írja le.
2. Meghatározás
Az e módszerrel meghatározott benzil-alkohol mennyiségét tömegszázalékban (% m/m) fejezzük ki.
3. Alapelv
A mintát metil-alkohollal vonjuk ki, és a kivonatban található benzil-alkohol mennyiségét nagynyomású folyadékkromatográfiával (HPLC) határozzuk meg.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie és alkalmasnak HPLC-re, ahol ez szükséges.
4.1. Metil-alkohol
4.2. 4-Etoxi-fenol
4.3. Benzil-alkohol
4.4. Mozgó fázis: metil-alkohol (4.1.) / víz (45:55; v/v)
4.5. Benzil-alkohol törzsoldat: mérjünk be pontossággal körülbelül 0,1 g benzil-alkoholt (4.3) egy 100 ml-es mérőlombikba. Töltsük fel a jelig metil-alkohollal (4.1.) és keverjük össze.
4.6. Belső standard oldat: mérjünk be nagy pontossággal mintegy 0,1 g 4-etoxifenolt (4.2.) egy 1 ml-es mérőlombikba. Töltsük fel a jelig metil-alkohollal (4.1) és keverjük össze.
4.7. Standard oldatok: egy sorozat 25 ml-es mérőlombikba pipettázzunk benzil-alkohol törzsoldatot (4.5.) és belső standard oldatot (4.6.) az alábbi táblázatban megadott mennyiségekben. Töltsük fel a jelig metil-alkohollal és keverjük össze.
| Standard oldat | Benzil-alkohol koncentráció | 3-etoxi-fenol koncentráció | |||
| hozzáadott ml (4.5.) | μm/ml * | hozzáadott ml (4.6.) | μm/ml * | ||
| I | 0,5 | 20 | 2,0 | 80 | |
| II | 1,0 | 40 | 2,0 | 80 | |
| III | 2,0 | 80 | 2,0 | 80 | |
| IV | 3,0 | 120 | 2,0 | 80 | |
| V | 5,0 | 200 | 2,0 | 80 | |
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés
5.2. Nagynyomású kromatográfiás berendezés változtatható hullámhosszú ultraibolya detektorral és 10 μl-es befecskendező hurok.
5.3. Analitikai oszlop: 250 mm x 4,6 mm rozsdamentes acél oszlop 5 μm-es Spherisorb ODS vagy ezzel egyenértékű töltettel ellátva.
5.4. Vízfürdő
5.5. Ultrahangos fürdő
5.6. Centrifuga
5.7. Centrifugacsövek, 15 ml kapacitással
6. Eljárás
6.1. Minta-előkészítés
6.1.1. Mérjünk be nagy pontossággal mintegy 0,1 g (m gramm) mintát egy centrifugacsőbe (5.7.) és adjunk hozzá 5 ml metil-alkoholt (4.1.).
6.1.2. Melegítsük vízfürdőn (5.4.) 10 percig 50 °C-ot tartva, azután tegyük a csövet ultrahangos fürdőbe (5.5.), amíg a minta teljesen feloldódik.
6.1.3. Hűtsük le, azután centrifugáljuk 3500 percenkénti fordulatszám mellett öt percig.
6.1.4. A felülúszó folyadékot töltsük át egy 25 ml-es mérőlombikba.
6.1.5. Újra vonjuk ki a mintát további 5 ml metil-alkohollal (4.1.). Egyesítsük a kivonatokat egy 25 ml-es mérőlombikban.
6.1.6. Pipettázzunk 2,0 ml belső standard oldatot (4.6.) egy 25 ml-es mérőlombikba. Töltsük fel jelig metil-alkohollal (4.1.) és keverjük össze. Ezt az oldatot használjuk a 6.4 pontban leírt vizsgálat meghatározási szakaszában.
6.2. Kromatográfia
6.2.1. Szereljük össze a nagynyomású kromatográfiás berendezést (5.2.) a szokásos módon. A mozgó fázis (4.4.) áramlási sebességét állítsuk 2,0 ml/ perc értékre.
6.2.2. Az UV detektor (5.2.) hullámhosszát állítsuk 210 nm-re.
6.3. Kalibrálás
6.3.1 Minden standard oldatból (4.7.) fecskendezzünk 10 μl-t, és mérjük meg a benzil-alkohol területeket és a 4-etoxi-fenol csúcsokat.
6.3.2 Minden standard oldatra (4.7.) számítsuk ki a benzil-alkoholnak a 4-etoxi-fenolhoz viszonyított csúcsterületek arányát. Vigyük fel ezeket az arányokat a kalibrációs görbe ordinátájára, a hozzátartozó benzil-alkohol koncentrációkat pedig az abszcisszára μg/milliliterben.
6.4 Mennyiségi meghatározás
6.4.1 Fecskendezzünk be 10 μl mintaoldatot (6.1.6.), és mérjük meg a benzil-alkohol és a 4-etoxi-fenol csúcsterületeit. Számítsuk ki a benzil-alkohol és a 4-etoxi-fenol csúcsterületek arányát. Ismételjük meg ezt a folyamatot további 10 μl-es mintaoldat részletekben, amíg ellentmondásmentes eredményeket kapunk.
6.4.2 A kalibrációs görbéről (6.3.2.) olvassuk le a benzil-alkohol/4-etoxifenol csúcsterülethez tartozó benzil-alkohol koncentrációt.
7. Számítás
Számítsuk ki a minta benzil-alkohol tartalmát tömegszázalékban a következő képlet segítségével:
| benzil-alkohol% (m/m) = | c ─── 400 x m | , |
ahol:
m = a vizsgálati minta (6.1.1.) tömege grammban;
és
c = a mintaoldatban (6.1.6.) lévő benzil-alkohol-koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján.
8. Megismételhetőség *
1% (m/m) benzil-alkohol-tartalom esetén azonos a mintán, párhuzamosan végzett két mennyiségi meghatározás eredménye közötti eltérés értéke nem haladhatja meg a 0,10%-ot.
A módszer öt lépést tartalmaz:
A. Cirkónium azonosítása
B. Cirkónium meghatározása
C. Alumínium meghatározása
D. Klór meghatározása
E. Az alumínium atomok cirkónium atomokhoz viszonyított aránya, valamint az alumínium és cirkónium atomok klór atomokhoz viszonyított arányának számítása
1. Cél és alkalmazási terület
Ez a módszer a nem-aeroszol izzadásgátló kozmetikai termékekben lévő cirkónium azonosítását írja le. Nem történt kísérlet olyan módszer leírására, amely az alumínium-cirkónium-klorid komplex [AlxZr(OH),Cl,.nH2O] azonosítására alkalmas.
2. Alapelv
A cirkóniumot jellemző, vörös-lila csapadéka alapján azonosítjuk, amely alizarin-vörös S oldattal képződik erősen savas környezetben.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált sósav (d20 = 1,18 g/ml)
3.2. Alizarin-vörös S (CL 58005) oldat: alizarin-szulfonát 2%-os (m/v) vizes oldata.
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
5. Eljárás
5.1. Körülbelül 1 g-nyi, vizsgálati csőben lévő mintához adjunk 2 ml vizet. Dugóval zárjuk le és rázzuk fel.
5.2. Adjunk hozzá néhány csepp alizarin-vörös S oldatot (3.2.), majd 2 ml koncentrált sósavat (3.1.). Dugóval zárjuk le és rázzuk össze.
5.3. Hagyjuk állni kb. két percig.
5.4. Vörös-ibolya színű felülúszó folyadék és csapadék a cirkónium jelenlétét jelzi.
1. Cél és alkalmazási terület
Ez a módszer a nem-aeroszol izzadásgátlókban lévő cirkóniumnak alumínium-cirkónium-klorid-hidroxid komplexekben történő meghatározására alkalmas legfeljebb 7,5% (m/m) cirkónium-koncentrációig.
2. Alapelv
A cirkóniumot savas körülmények között kivonjuk a termékből és atomabszorpciós lángspektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált sósav (d20 = 1,18 g/ml)
3.2. 10%-os (v/v) sósav oldat: adjunk 100 ml koncentrált sósavat (3.1.) 500 ml vízhez egy főzőpohárban, folyamatos keverés mellett. Töltsük át ezt az oldatot egy 1 literes mérőlombikba és töltsük fel a jelig vízzel.
3.3. Cirkónium standard törzsoldat, 1000 μg/ml-es, 0,5 M-os sósav oldatban („SpectrosoL” vagy ezzel megegyező)
3.4. Alumínium-klorid (hidratált) [AlCl36.H2O] reagens: oldjunk fel 22,6 g alumínium-klorid-hexahidrátot 250 ml 10%-os (v/v) sósav oldatban (3.2.).
3.5. Ammónium-klorid reagens: oldjunk fel 5,0 g ammónium-kloridot 250 ml 10%-os (v/v) sósav oldatban (3.2.).
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. Főzőlap mágneses keverővel
4.3. Szűrőpapír (Whatman. 41. számú vagy ezzel megegyező)
4.4. Cirkónium üregkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1. Minta-előkészítés
5.1.1. Mérjünk be pontosan kb. 0,1 g (m gramm) homogén mintát a termékből egy 150 ml-es főzőpohárba. Adjunk hozzá 40 ml vizet és 10 ml koncentrált sósavat (3.1.).
5.1.2. Tegyük fel a főzőpoharat a mágneses keverővel ellátott főzőlapra (4.2.). Indítsuk el a keverést és forrásig melegítsük. A gyors száradás megelőzése érdekében tegyünk egy óraüveget a főzőpohár tetejére. Forraljuk öt percig, vegyük le a főzőpoharat a hűtsük le szobahőmérsékletre.
5.1.3. A szűrőpapír (4.3.) felhasználásával szűrjük le a főzőpohár tartalmát egy 100 ml-es mérőlombikba. Öblítsük ki a főzőpoharat kétszer 10 ml-nyi vízzel, és szűrés után öntsük a szűrletet a lombikba. Töltsük fel a jelig vízzel és keverjük meg. Ezt az oldatot használjuk az alumínium (C. rész) meghatározására is.
5.1.4. Pipettázzunk 20,00 ml mintaoldatot (5.1.3), 5,00 ml alumínium-klorid reagenst (3.4.) és 5,00 ml ammónium-klorid reagenst (3.5.) egy 50 ml-es mérőlombikba. Töltsük fel a jelig 10%-os (v/v) sósav oldattal (3.2.) és keverjük meg.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: nitrogénoxid-acetilén
Hullámhossz: 360,1 nm
Háttér korrekció: nincs
Fűtési körülmények: dús; a maximális abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1. Egy 50 ml-es mérőlombik sorozatba pipettázzunk be 5,00; 10,00; 15,00; 20,00 és 25,00 ml cirkónium standard törzsoldatot (3.3.). Mindegyik mérőlombikba pipettázzunk be 5,00 ml alumínium-klorid reagenst (3.4.) és 5,00 ml ammónium-klorid reagenst (3.5.) Töltsük fel mindegyik lombikot a jelig 10%-os (v/v) sósav oldattal (3.2.) és keverjük meg. Ezek az oldatok 100, 200, 300, 400 és 500 μg cirkóniumot tartalmaznak milliliterenként.
Hasonlóképpen készítsünk el egy vakpróba oldatot is, amelyből kihagyjuk a cirkónium standard oldatot.
5.3.2. Mérjük meg a vakpróba oldat (5.3.1.) abszorbanciáját, és a kapott értéket a kalibrációs görbe nulla cirkónium koncentrációjaként használjuk. Mérjük meg mindegyik cirkónium kalibráló standard oldat (5.3.1.) abszorbanciáját. Rajzoljuk meg a kalibrációs görbét, ábrázoljuk az abszorbancia értékeket a cirkónium-koncentráció függvényében.
5.4. Meghatározás
Mérjük meg a mintaoldat (5.1.4.) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó cirkónium-koncentrációt.
6. Számítás
Számítsuk ki a minta cirkónium tartalmát tömegszázalékban (% m/m) a következő képlet használatával:
| cirkónium% (m/m) = | c ─── 40 x m | , |
ahol:
m = a vizsgálathoz kivett minta (5.1.1.) tömege grammban;
és
c = a mintaoldatban (5.1.) lévő cirkónium-koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján.
7. Megismételhetőség *
3,00% (m/m) cirkónium-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározása közötti különbség értéke nem haladhatja meg a 0,10%-ot (m/m).
8. Megjegyzés
A atomabszorpciós lángspektrometria mellett megengedett az induktív kapcsolású plazma-emissziós optikai spektrometria használata.
1. Cél és alkalmazási terület
Ez a módszer a nem-aeroszol izzadásgátlókban található alumínium-cirkónium-klorid-hidroxid komplexekben lévő alumínium meghatározására alkalmas legfeljebb 12% (m/m) alumínium-koncentrációig.
2. Alapelv
Az alumíniumot savas körülmények között kivonjuk a termékből, és atomabszorpciós lángspektrometriával határozzuk meg.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált sósav (d20 = 1,18 g/ml)
3.2. 1%-os (v/v) sósav oldat: adjunk 10 ml koncentrált sósavat (3.1.) 500 ml vízhez egy főzőpohárban, folyamatos keverés mellett. Töltsük át ezt az oldatot egy 1 literes mérőlombikba és töltsük fel a jelig vízzel.
3.3. Alumínium mérő törzsoldat, 1000 μg/ml-es, 0,5 M-os salétromsav oldatban („SpectrosoL” vagy ezzel megegyező)
3.4. Kálium-klorid reagens: oldjunk fel 10,0 g kálium-kloridot 250 ml 10%-os (v/v) sósav oldatban (3.2.).
4. Eszközök
4.1. Szokásos laboratóriumi felszerelés
4.2. Alumínium üregkatódos lámpával felszerelt atomabszorpciós spektrométer.
5. Eljárás
5.1. Minta-előkészítés
A B.5.1.3. pontban elkészített oldatot használjuk az alumíniumtartalom meghatározására.
5.1.1. Pipettázzunk 5,00 ml mintaoldatot (5.1.3.) és 10,00 ml kálium-klorid reagenst (3.4.) egy 100 ml-es mérőlombikba. Töltsük fel jelig 1%-os (v/v) sósav oldattal (3.2.), és keverjük meg.
5.2. Feltételek az atomabszorpciós spektrometriához
Láng: nitrogénoxid-acetilén
Hullámhossz: 309,3 nm
Háttér korrekció: nincs
Fűtési körülmények: dús; a legnagyobb abszorbancia biztosításához szükség lesz a lángmagasság és a fűtési körülmények optimalizálására.
5.3. Kalibrálás
5.3.1. Egy 100 ml-es mérőlombik sorozatba pipettázzunk be 1,00; 2,00; 3,00; 4,00 és 5,00 ml alumínium mérő törzsoldatot (3.3.). Mindegyik mérőlombikba pipettázzunk be 10,00 ml kálium-klorid reagenst (3.4.) és töltsük fel mindegyik lombikot a jelig 1%-os (v/v) sósav oldattal (3.2.) és keverjük meg. Ezek az oldatok 10, 20, 30, 40 és 50 μg alumíniumot tartalmaznak milliliterenként.
Hasonlóképpen készítsünk el egy vakpróba oldatot is, amelyből kihagyjuk az alumínium mérőoldatot.
5.3.2. Mérjük meg a vakoldat (5.3.1.) abszorbanciáját, és a kapott értéket a kalibrációs görbe nulla alumínium koncentrációjaként használjuk. Mérjük meg mindegyik alumínium kalibráló mérőoldat abszorbanciáját. Rajzoljuk meg a kalibrációs görbét az abszorbancia értékeknek az alumínium-koncentráció függvényében való ábrázolásával.
5.4. Meghatározás
Mérjük meg a mintaoldat (5.1.1.) abszorbanciáját. A kalibrációs görbéről olvassuk le a mintaoldatra kapott abszorbanciához tartozó alumínium-koncentrációt.
6. Számítás
Számítsuk ki a minta alumíniumtartalmát tömegszázalékban (% m/m) a következő képlet segítségével:
| alumínium% (m/m) = | c ─── 5 x m | , |
ahol:
m = a vizsgálati minta (B.5.1.1.) tömege grammban;
és
c = a mintaoldatban (5.1.1.) lévő alumínium-koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján.
7. Megismételhetőség *
3,5% (m/m) alumíniumtartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredménye közötti eltérés értéke nem haladhatja meg a 0,10%-ot (m/m).
8. Megjegyzés
Az atomabszorpciós lángspektrometria mellett megengedett az induktív kapcsolású plazma – emissziós optikai spektrometria használata.
1. Cél és alkalmazási terület
Ez a módszer a nem-aeroszol izzadásgátlókban lévő alumínium-cirkónium-klorid-hidroxid komplexekben klorid ionok formájában jelenlévő klór meghatározására alkalmas.
2. Alapelv
A termékben lévő klorid iont potenciometrikus titrálással határozzuk meg ezüst-nitrát mérőoldatra vonatkoztatva.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Koncentrált salétromsav (d20 = 1,42 g/ml)
3.2. 5%-os (v/v) salétromsav oldat: adjunk 25 ml koncentrált salétromsavat (3.1.) 250 ml vízhez egy főzőpohárban, folyamatos keverés mellett. Töltsük át ezt az oldatot egy 500 ml-es mérőlombikba és töltsük fel a jelig vízzel.
3.3. Aceton
3.4. 0,1 M-os ezüst-nitrát oldat („AnalaR” vagy ezzel egyenértékű)
4. Eszközök
4.1. Szokásos laboratóriumi felszerelések
4.2. Mágneses keverővel ellátott főzőlap
4.3. Ezüst elektród
4.4. Kalomel referencia elektród
4.5. Potenciometrikus titrálásra alkalmas pH/milivolt mérő
5. Eljárás
5.1 Minta-előkészítés
5.1.1. Mérjünk be pontosan kb. 1,0 g-ot (m gramm) a termék homogén mintájából egy 250 ml-es főzőpohárba. Adjunk hozzá 80 ml vizet és 20 ml 5%-os (v/v) salétromsav (3.2.) oldatot.
5.1.2. Tegyük a főzőpoharat a mágneses keverővel ellátott főzőlapra (4.2.). Indítsuk el a keverést, és melegítsük forrásig. A gyors kiszáradás elkerülése érdekében tegyünk egy óraüveget a főzőpohár tetejére. Forraljuk öt percen keresztül, aztán vegyük le a főzőpoharat a főzőlapról és hűtsük le szobahőmérsékletűre.
5.1.3. Adjunk hozzá 10 ml acetont (3.3.), merítsük az elektródokat az oldat felszíne alá, és indítsuk meg a keverést. Titráljuk potenciometriásan 0,1 M-os ezüst-nitráttal (3.4.), és rajzoljuk fel a differenciálgörbét a végpont („V” ml) meghatározásához.
6. Számítás
Számítsuk ki a minta klór tartalmát tömegszázalékban (% m/m) a következő képlet segítségével:
| klór% (m/m) = | 0,3545 x V ───── m | , |
ahol:
m = a vizsgálati minta (5.1.1.) tömege grammban;
és
V = a titrálás végpontjában a 0,1 M-os ezüst-nitrát térfogata milliliterben (5.1.3.)
7. Megismételhetőség *
4% (m/m) klór-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti eltérés értéke nem haladhatja meg a 0,10%-ot (m/m).
1. Az alumínium atomok cirkónium atomokhoz viszonyított arányának számítása
Az Al : Zr arányt a következő képlettel számítjuk ki:
| Al : Zr arány = | Al% (m/m) x 91,22 ──────── Zr% (m/m) x 26,98 |
2. Az alumínium és cirkónium atomok klóratomokhoz viszonyított arányának számítása
Az (Al + Zr): Cl arányt a következő képlettel számítjuk ki:
| Al% (m/m) ───── 26,98 | + | Zr% (m/m) ───── 91,22 | ||
| (Al + Zr) : Cl arány = | ──────────── | |||
| Cl% (m/m) ───── 35,45 | ||||
1. Cél és alkalmazási terület
Ez a módszer a következő vegyületek minőségi és mennyiségi meghatározását írja le:
– hexamidin és sói, beleértve az izotianátot és a 4-hidroxi-benzoátot,
– dibróm-hexamidin és sói, beleértve az izotianátot,
– dibróm-propamidin és sói, beleértve az izotianátot,
– klór-hexidin-diacetát, -diglikonát és -dihidro-klorid kozmetikai termékekben.
2. Fogalommeghatározás
Az e módszerrel meghatározott hexamidin, dibróm-hexamidin, dibróm-propamidin és klór-hexidin koncentrációkat tömegszázalékban (% m/m) fejezzük ki.
3. Alapelv
Az azonosítást és meghatározást nagynyomású, fordított fázisú ionpár-folyadékkromatográfiával (HPLC) határozzuk meg, amit ultraibolya spektrofotometriás detektálás követ. A hexamidint, dibróm-hexamidint, dibróm-propamidint és klór-hexidint a kromatográfiás oszlopon mért retenciós idejük alapján azonosítjuk.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie és HPLC-hez megfelelőnek.
4.1. Metil-alkohol
4.2. 1-heptánszulfonsav nátriumsója, monohidrát
4.3. Ecetsav (jégecet), (d20 = 1,05 g/ml)
4.4. Nátrium-klorid
4.5. Mozgó fázisok
4.5.1. I. oldószer: 0,005 M-os 1-heptán-szulfonsav nátrium sója monohidrát (4.2.) metil-alkoholban (4.1.), pH 3,5 értékre beállítva jégecettel (4.3.).
4.5.2. II. oldószer: 0,005 M-os 1-heptán-szulfonsav nátrium sója monohidrát (4.2.) vízben pH 3,5 értékre beállítva jégecettel (4.3.).
Megjegyzés: Ha szükséges a csúcsok alakjának javítása, a mozgó fázist módosítani lehet, és a következőképpen lehet elkészíteni:
– I. oldószer: oldjunk fel 5,84 g nátrium-kloridot (4.4.) és 1,1013 g 1-heptán-szulfonsav nátriumsó monohidrátot (4.2.) 100 ml vízben. Adjunk hozzá 900 ml metil-alkoholt (4.1.), és a pH-t jégecettel állítsuk be 3,5 értékre.
– II. oldószer: oldjunk fel 5,84 g nátrium-kloridot (4.4,) és 1.1013 g 1-heptán-szulfonsav nátriumsó monohidrátot (4.2.) 1 liter vízben, és a pH-t jégecettel állítsuk be 3,5 értékre.
4.6. Hexamidin diizotianát [C20H26N4O22C2H6O4S]
4.7. Dibróm-hexamidin diizotianát [C20H24Br2N4O2 2C2H6O4S]
4.8. Dibróm-propamidin diizotianát [C17H18Br2N4O2 2C2H6O4S]
4.9. Klór-hexidin diacetát [C22H30Cl2N10 2C2H4O2]
4.10. Referenciaoldatok: készítsünk 0,05%-os (m/v) oldatokat a négy tartósítószer (4.6–4.9.) mindegyikéből az I. oldószer segítségével.
4.11. 3,4,4’-triklór-karbanilid (triklokarbán)
4.12. 4,4’-Diklór-3-(trifluormetil)karbanilid (halokarbán)
5. Eszközök
5.1. Szokásos laboratóriumi felszerelés
5.2. Nagynyomású folyadékkromatográfia változtatható hullámhosszú ultraibolya detektorral
5.3. Analitikai oszlop: 30 cm hosszú, 4 mm belső átmérőjű rozsdamentes acél oszlop μ-Bondapack C18 10 μm-es vagy ezzel megegyező töltetű.
5.4. Ultrahangos fürdő
6. Azonosítás
6.1. Minta-előkészítés
Mérjünk be körülbelül 0,5 g mintát egy 10 ml-es mérőlombikba és töltsük fel a jelig az I. oldószerrel (4.5.1.). Tegyük be a mérőlombikot az ultrahangos fürdőbe (5.4.) 10 percre.
Szűrjük vagy centrifugáljuk le az oldatot. Gyűjtsük össze a szűrletet vagy a felülúszó részt a kromatografáláshoz.
6.2. Kromatográfia
6.2.1. A mozgó fázis gradiense
| Idő (perc) | I. oldószer (% v/v) (4.5.1.) | II. oldószer (% v/v) (4.5.2.) | |
| 0 | 50 | 50 | |
| 15 | 65 | 35 | |
| 30 | 65 | 35 | |
| 45 | 50 | 50 |
6.2.2. Állítsuk be a mozgó fázis (6.2.1.) áramlási sebességét 1,5 ml/min értékre, az oszlop hőmérsékletét pedig 35 °C-ra.
6.2.3. Állítsuk a detektor hullámhosszát 264 nm-re
6.2.4. Fecskendezzünk be 10 μl-t mindegyik referenciaoldatból (4.10.), és vegyük fel a kromatogramokat.
6.2.5. Fecskendezzünk be 10 μl-t a mintaoldatból (6.1), és vegyük fel ennek kromatogramját.
6.3. Azonosítsuk, hogy hexamidin, dibróm-hexamidin, dibróm-propamidin vagy klór-hexidin ott van-e úgy, hogy a 6.2.5. pontban rögzített csúcs(ok) retenciós idejét(időit) hasonlítsuk össze a 6.2.4. pontban rögzített referenciaoldatokéval.
7. Mennyiségi meghatározás
7.1. Standard oldatok elkészítése.
Belső standard oldatként egy olyan tartósítószert (4.6–4.9.) használunk, amely nincs a mintában. Ha ez nem lehetséges, triklókarbán (4.11.) vagy halokarbán (4.12.) használható.
7.1.1. A 6.3. pontban azonosított tartósítószer 0,05%-os (m/v) törzsoldata az I. oldószerben (4.5.1.).
7.1.2. A belső standardként választott tartósítószer 0,05%-os (m/v) törzsoldata az I. oldószerben (4.5.1.).
7.1.3. Mindegyik azonosított tartósítószerhez készítsünk négy standard oldatot úgy, hogy egy 10 ml-es mérőlombik sorozatba betöltünk az alábbi táblázatban megadott mennyiségű törzsoldatot az azonosított tartósítószerből (7.1.1.) és megfelelő mennyiségű törzsoldatot a belső standardból (7.1.2.). Töltsük fel a lombikokat a jelig az I. oldószerrel (4.5.1.), és keverjük meg őket.
| Belső standard törzsoldat | Azonosított tartósítószer törzsoldata | |||
| Standard oldat | hozzáadott ml (7.1.2.) | hozzáadott ml (7.1.1.) | μg/ml * | |
| I | 1.0 | 0.5 | 25 | |
| II | 1.0 | 1.0 | 50 | |
| III | 1.0 | 1.5 | 75 | |
| IV | 1.0 | 2.0 | 100 | |
7.2. Minta-előkészítés
7.2.1. Mérjünk be nagy pontossággal kb. 0,5 g (p gramm) mintát egy 10 ml-es mérőlombikba; adjunk hozzá 1,0 ml-t a belső standard oldatból (7.1.2.) és 6 ml oldószert (4.5.1.), majd keverjük össze.
7.2.2. Tegyük be a lombikot az ultrahangos fürdőbe (5.4.) 10 percre. Töltsük fel a jelig az I. oldószerrel és keverjük meg. Centrifugáljuk le vagy szűrjük át egy hajtogatott szűrőpapíron. Gyűjtsük össze a szűrletet vagy a felülúszó részt (amit a konkrét eset határoz meg) a kromatografáláshoz.
7.3. Kromatográfia
7.3.1. Állítsuk be a mozgó fázis gradiensét, áramlási sebességét, az oszlop hőmérsékletét és a detektor hullámhosszát a HPLC készüléken (5.2.) olyan értékekre, mint amilyenekre az azonosítás szakaszában (6.2.1–6.2.3.) szükség volt.
7.3.2. Fecskendezzünk 10 μl mintaoldatot (7.2.2.), és mérjük meg a csúcsterületeket. Ismételjük meg ezt a folyamatot további 10 μl-es mintaoldat részletekkel addig, amíg ellentmondásmentes eredményeket kapunk. Számítsuk ki az elemezni kívánt vegyület csúcsának területe és a belső standard csúcsának területe közötti arányát.
7.4. Kalibrálás
7.4.1. Fecskendezzünk be minden standard oldatból (7.1.3) 10 μl-t és mérjük meg a csúcsterületeket.
7.4.2. Számítsuk ki minden standard oldatra (7.1.3.) a hexamidin, dibróm-hexamidin, dibróm-propamidin vagy klór-hexidin csúcsok területének és a belső standard csúcs területének arányát. Vigyük fel a kalibrációs görbe ordinátájára ezeket az arányokat, míg a belső standard oldatokban lévő azonosított tartósítószerek megfelelő koncentrációit, mikrogramm/milliliter értékben, az abszcisszára.
7.4.3. A kalibrációs görbéről (7.4.2.) olvassuk le az azonosított tartósítószer 7.3.2. pontban számított csúcsterület aránynak megfelelő koncentrációját.
8. Számítás
Számítsuk ki a minta hexamidin, dibróm-hexamidin, dibróm-propamidin vagy klór-hexidin tartalmát tömegszázalékban a következő képlet segítségével:
| % (m/m)= | c ──── 1000 x p | x | MW1 ─── MW2 | , |
ahol:
p = a vizsgálati minta (7.2.1.) tömege grammban;
c = a mintaoldatban lévő tartósítószer koncentráció mikrogramm/milliliterben, a kalibrációs görbe alapján;
MW1 = a jelen lévő tartósítószer alapformájának molekulasúlya;
és
MW2 = a megfelelő só (lásd a 10. pont) molekulasúlya.
9. Megismételhetőség *
0,1% (m/m) hexamidin-, dibróm-hexamidin-, dibróm-propamidin- vagy klór-hexidin-tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség értéke nem haladhatja meg a 0,005%-ot.
10. A képlet szerinti súlyok táblázata
| Hexamidin | C20H26N4O2 | 354,45 | |
| Hexamidin diizotianát | C20H26N4O2 2C2H6O4S | 606,72 | |
| Hexamidin di-p-hidroxi-benzoát | C20H26N4O2 2C2H6O4 | 630,71 | |
| Dibróm-hexamidin | C20H24Br2N4O2 | 512,24 | |
| Dibróm-hexamidin diizotianát | C20H24Br2N4O2 2C2H6O4S | 764,51 | |
| Dibróm-propamidin | C17H18Br2N4O2 | 470,18 | |
| Dibróm-propamidin diizotianát | C17H18Br2N4O2 2C2H6O4S | 722,43 | |
| Klór-hexidin | C22H30Cl2N10 | 505,45 | |
| Klór-hexidin diacetát | C22H30Cl2N10 2C2H4O2 | 625,56 | |
| Klór-hexidin diglukonát | C22H30Cl2N10 2C6H12O2 | 897,76 | |
| Klór-hexidin dihidroklorid | C22H30Cl2N10 2HCl | 578,37 |
(A 93/73/EGK irányelv alapján)
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben lévő benzoesav, 4-hidroxibenzoesav, szorbinsav, szalicilsav és propionsav azonosítására és mennyiségi meghatározására alkalmas. Külön eljárások írják le ezeknek a tartósítószereknek az azonosítását; a propionsav meghatározását; valamint a 4-hidroxibenzoesav, szalicilsav, szorbinsav és benzoesav meghatározását.
2. Fogalommeghatározás
Az e módszerrel meghatározott benzoesav, 4-hidroxibenzoesav, szalicilsav, szorbinsav és propionsav mennyiségét a szabad savak tömegszázalékában kifejezzük ki.
1. Alapelv
A tartósítószerek sav/bázis kivonását követően a kivonatot vékonyréteg kromatográfiával (TLC) elemezzük, a derivatizációt a mérés napján végezzük el. Az eredményektől függően az azonosítást nagynyomású folyadékkromatográfiával (HPLC) erősítjük meg, vagy propionsav esetében gázkromatográfiával (GC).
2. Reagensek
2.1. Általános rész
Minden reagensnek analitikai tisztaságúnak kell lennie. A felhasznált víznek desztillált víznek vagy legalább azzal egyenértékű tisztaságú víznek kell lennie.
2.2. Aceton
2.3. Dietil-éter
2.4. Acetonitril
2.5. Toluol
2.6. n-Hexán
2.7. Folyékony paraffin
2.8. 4 M-os sósav
2.9. Kálium-hidroxid 4 M-os vizes oldata
2.10. Kalcium-klorid, CaCl2 2H2O
2.11. Lítium-karbonát, Li2CO3
2.12. 2-bróm-2’-acetonafton
2.13. 4-hidroxibenzoesav
2.14. Szalicilsav
2.15. Benzoesav
2.16. Szorbinsav
2.17. Propionsav
2.18. Referenciaoldatok
Készítsünk 0,1%-os (m/v) (100 mg/100 ml) oldatokat mind az öt tartósítószerből (2.13–2.17.) dietil-éterrel.
2.19. Derivatizáló reagens
2-bróm-2’-acetonafton (2.12.) 0,5%-os (m/v) acetonitriles oldata (2.4.) (50 mg/10 ml). Ezt az oldatot hetente kell készíteni, és hűtőszekrényben kell tárolni.
2.20. Katalizátor oldat
Lítium-karbonát (2.11) 0,3%-os vizes oldata (300 mg/100 ml). Ezt az oldatot frissen kell készíteni.
2.21. Futtató szer
Toluol (2.5.) / aceton (2.2.) (20:0,5 v/v)
2.22. Folyékony paraffin (2.7.) / n-hexán (2.6.) (1:2 v/v)
3. Eszközök
Szokásos laboratóriumi felszerelés
3.1. 60 °C hőmérséklet tartására alkalmas vízfürdő
3.2. Előhívó kád
3.3. Ultraibolya fényforrás, 254 és 366 nm
3.4. Vékonyréteg lemezek, Kieselgel 60, fluorescens indikátor nélkül, 20 x 20 cm, rétegvastagság 0,25 mm, 2,5 x 20 cm-es koncentráló zónával (Merck 11845 vagy ezzel egyenértékű)
3.5. 10 μl-es mikrofecskendő
3.6. 25 μl-es mikrofecskendő
3.7. Maximum 105 °C hőmérséklet tartására alkalmas szárítószekrény
3.8. 50 ml-es üvegcsövek csavaros kupakkal
3.9. Szűrőpapír 90 mm átmérővel, Schleicher és Schull, 5892 Weissband vagy ezzel egyenértékű
3.10. Univerzális pH indikátorpapír, pH 1–11
3.11. 5 ml-es üveg mintatartó ampullák
3.12. Rotációs bepárló (Rotavapor vagy ezzel egyenértékű)
3.13. Főzőlap
4. Eljárás
4.1. Minta-előkészítés
Mérjünk be hozzávetőlegesen 1 g mintát egy 50 ml-es csavaros kupakú üvegcsőbe (3.8.). Adjunk hozzá négy csepp 4 M-os sósavat (2.8.) és 40 ml acetont (2.2.). Erősen lúgos termékeknél, mint amilyen a mosdószappan, 20 csepp 4 M-os sósavat (2.8.) kell adagolni. Indikátorpapírral (3.10) ellenőrizzük, hogy a pH 2 körüli értékű legyen. Zárjuk le a csövet és rázzuk erősen egy percig.
Ha szükség van a tartósítószerek acetonos fázisba történő egyszerűbb kivonásának elősegítésére, enyhén melegítsük a keveréket körülbelül 60 °C-ra, hogy a folyadékfázist beolvasszuk.
Hűtsük le az oldatot szobahőmérsékletre és szűrjük át szűrőpapíron (3.9.) egy Erlenmeyer lombikba.
Töltsünk 20 ml szűrletet 200 ml-es Erlenmeyer lombikba, adjunk hozzá 20 ml vizet és keverjük össze. 4 M-os kálium-hidroxiddal (2.9.) állítsuk be a keverék pH-ját körülbelül 10-es értékre úgy, hogy a pH mérésére indikátorpapírt (3.10.) használunk.
Adjunk hozzá 1 g kalcium-kloridot (2.10.) és rázzuk fel erősen. Szűrőpapíron (3.9) szűrjük át 250 ml-es Erlenmeyer lombikba, ami 75 ml dietil-étert (2.3.) tartalmaz és rázzuk erősen egy percig. Hagyjuk szétválni, és a vizes réteget vigyük át egy 250 ml-es Erlenmeyer lombikba. Öntsük el az éteres réteget. Indikátorpapír (3.10.) segítségével a vizes oldat pH-ját 4 M-os sósavval (2.8.) állítsuk be körülbelül pH 2-re. Adjunk hozzá 10 ml dietil-étert (2.3.), dugjuk be a lombikot és rázzuk erősen egy percig. Hagyjuk szétválni, és az éteres réteget töltsük át egy rotációs bepárlóba (3.12.). Öntsük ki a vizes réteget.
Párologtassuk az éteres réteget csaknem szárazra, és a maradékot újra oldjuk fel 1 ml dietil-éterben (2.3.). Töltsük az oldatot a mintatartó ampullába (3.11.).
4.2. Vékonyréteg kromatográfia
Minden kromatografálásra kerülő referencia- és mintaoldat esetében (3.5.) egy fecskendővel vigyünk fel hozzávetőlegesen 3 μl lítium-karbonát oldatot (2.20.) a TLC lemez (3.4.) koncentrációs zónájának alapvonalára, egyenlő távolságokban és szárítsuk hideg levegőáramban.
Hogy a foltokat annyira kis területen tartsuk, amennyire csak lehet, tegyük át a TLC lemezt egy 40 °C-ra melegített főzőlapra (3.13.). Egy mikrofecskendővel (3.5.) vigyünk fel 10 μl-t minden egyes referenciaoldatból (2.18.) és mintaoldatból (4.1.) a lemez alapvonalára, pontosan azokra a foltokra, ahova a lítium-karbonát oldatot is felvittük.
Végül vigyünk fel körülbelül 15 μl derivatizáló reagenst (2.19) (2-bromo-2-acetonafton oldat) megint pontosan azokra a foltokra, ahová a referencia- és mintaoldatokat és a lítium-karbonát oldatot is felvittük.
Tegyük a lemezt 80 °C-os szárítószekrénybe (3.7.) 45 percig. Lehűlés után – szűrőpapír bevonat használata nélkül – tegyük a lemezt egy olyan futtató kádba (3.2.), amelyet előtte 15 percig telítettünk a 2.21 futtató szerrel (toluol/aceton) és addig futtassuk, amíg az oldószer front 15 cm-es magasságig ér el (ez körülbelül 80 percet vesz igénybe).
Szárítsuk meg a lemezt hideg levegőáramban és vizsgáljuk meg a kapott foltokat UV fényben (3.3). A gyenge foltok fluoreszkálásának növelése érdekében a TLC lemezt be lehet mártani folyékony paraffin/ n-hexán keverékbe (2.22.).
5. Azonosítás
Határozzuk meg minden egyes folt Rf értékét. Hasonlítsuk össze a minták Rf értékét és az UV sugárzás alatti intenzitását a referenciaoldatokéval.
Ezen adatok segítségével azonosíthatjuk a tartósítószereket, vagy következtethetünk jelenlétükre. Hajtsuk végre a B. fejezetben leírt HPLC vizsgálatot. Amennyiben propionsav jelenlétét tapasztaljuk, akkor a C. fejezetben leírt GC vizsgálatot végezzük el és hasonlítsuk össze a kapott retenciós időket a referenciaoldatok retenciós időivel.
Vessük össze a TLC-vel, HPLC-vel vagy GC-vel kapott eredményeket és az összesített eredmények alapján véglegesen azonosítsuk a mintában jelen lévő tartósítószereket.
1. Alapelv
Savanyítást követően a mintát etil-alkohol és víz elegyével kivonjuk. Szűrés után a tartósítószereket nagynyomású folyadékkromatográfiával (HPLC) határozzuk meg.
2. Reagensek
2.1. Minden reagensnek analitikai és HPLC tisztaságúnak kell lennie ott, ahol ez szükséges. A felhasznált víznek desztillált víznek vagy legalább ezzel egyenértékű tisztaságú víznek kell lennie.
2.2. Abszolút etil-alkohol
2.3. 4-hidroxibenzoesav
2.4. Szalicilsav
2.5. Benzoesav
2.6. Szorbinsav
2.7. Nátrium-acetát (CH3COONa.3H2O)
2.8. Ecetsav (α)420 = 1,05 g/ ml
2.9. Acetonitril
2.10. 2 M-os kénsav
2.11. Kálium-hidroxid 0,2 M-os vizes oldata
2.12. 2-metoxibenzoesav
2.13. Etil-alkohol/víz keverék
Keverjünk össze kilenc térfogatrész etil-alkoholt (2.2.) és egy térfogatrész vizet (2.1.)
2.14. Belső standard oldat
Készítsünk egy olyan oldatot, ami hozzávetőlegesen 1 g 2-metoxibenzoesavat (2.12.) tartalmaz 500 ml etil-alkohol/víz elegyben (2.13.)
2.15. Mozgó fázis a HPLC-hez
2.15.1. Acetát puffer: 1 liter vízhez adjunk 6,35 g nátrium-acetátot (2.7.) és 20,0 ml ecetsavat, majd keverjük össze.
2.15.2. A mozgó fázist úgy készítsük el, hogy keverjünk össze kilenc térfogatrész acetát puffert (2.15.1.) egy térfogatrész acetonitrillel (2.9.)
2.16. Tartósítószer törzsoldat
Pontosan mérjünk be 0,05 g 4-hidroxibenzoesavat (2.3.), 0,2 g szalicilsavat (2.4.), 0,2 g benzoesavat (2.5.) és 0,05 g szorbinsavat (2.6.) egy 50 ml-es mérőlombikba és töltsük fel jelig etil-alkohol/víz eleggyel (2.13.). Tároljuk ezt az oldatot hűtőszekrényben. Az oldat egy hétig megfelelő.
2.17. Tartósítószerek standard oldata
Töltsünk 8,00; 4,00; 2,00; 1,00 és 0,50 ml törzsoldatot (2.16.) egy sorozat 20 ml-es mérőlombikba. Minden lombikba adjunk 10,00 ml belső standard oldatot (2.14.) és 0,5 ml 2 M-os kénsavat. Töltsük fel a jelig etil-alkohol/víz eleggyel (2.13.). Ezeket az oldatokat frissen kell készíteni.
3. Eszközök
Szokásos laboratóriumi felszerelés, ha nincs külön meghatározva, valamint:
3.1. Vízfürdő 60 °C-ra beállítva
3.2. Nagynyomású folyadékkromatográf változtatható hullámhosszú UV detektorral és 10 μl-es befecskendező hurokkal
3.3. Analitikai oszlop
Rozsdamentes acél, 12,5–25 cm, belső átmérő 4,6 mm, Nucleosil 5C18-al vagy ezzel egyenértékű töltetű
3.4. 90 mm átmérőjű szűrőpapír, Schleicher és Schull, 5892 Weissband vagy ezzel egyenértékű
3.5. 50 ml-es üvegcsövek csavaros kupakkal
3.6. 5 ml-es üveg mintatartó ampullák
3.7. 2–4 mm méretű üveggyöngy, vagy homogenizálás céljára ezzel azonosanyag (pl. horzsakő)
4. Eljárás
4.1. Minta-előkészítés
4.1.1. A minta előkészítése belső standard hozzáadása nélkül
Mérjünk be 1 g-nyi mintát egy 50 ml-es csavaros fedelű üvegcsőbe (3.5.). Pipettával csepegtessünk 1,00 ml 2 M-os kénsavat (2.10.) és 40,0 ml etil-alkohol/víz elegyet (2.13.) a csőbe. Adjunk hozzá kb. 1 g üveggyöngyöt (3.7.), zárjuk le a csövet és rázzuk erősen legalább egy percig, míg homogén szuszpenziót nem kapunk. Ahhoz, hogy a tartósítószerek az etanolos fázisbavaló kivonását elősegítsük, tegyük a csövet pontosan 5 percre 60 °C-os vízfürdőbe (3.1.).
Azonnal hűtsük le a csövet hideg vízáramban és tartsuk a kivonatot 5 °C-on egy órán keresztül. Majd szűrjük le szűrőpapíron (3.4.) keresztül. Töltsünk át körülbelül 2 ml kivonatot egy mintatartó ampullába (3.6.) és tartsuk 5 °C-on. A HPLC-s meghatározást 24 órán belül végezzük el.
4.1.2. A minta előkészítése belső standard hozzáadásával
Mérjünk be három tizedes pontossággal 1±0,1 g mintát egy 50 ml-es csavaros fedelű üvegcsőbe (3.5.). Pipettával adjunk hozzá 1,00 ml 2 M-os kénsavat (2.10.) és 30,0 ml etil-alkohol/víz elegyet (2.13.). Adjunk hozzá körülbelül 1 g üveggyöngyöt (3.7.) és 10,00 ml belső standard oldatot (2.14.). Zárjuk le a csövet és rázzuk erősen legalább egy percig, amíg homogén szuszpenziót nem kapunk. Ahhoz, hogy elősegítsük a tartósítószerek kivonását az etanolos fázisba, tegyük a csövet pontosan 5 percre 60 °C-os vízfürdőbe (3.1.).
Azonnal hűtsük le a csövet hideg vízáramban, és tartsuk a kivonatot 5 °C-on egy órán keresztül. Majd szűrjük le szűrőpapíron (3.4.) keresztül. Töltsünk át körülbelül 2 ml kivonatot egy mintatartó ampullába (3.6.) és tartsuk 5 °C-on. A HPLC-s meghatározást 24 órán belül végezzük el.
4.2. Nagynyomású folyadékkromatográfia
Mozgó fázis: acetonitril/acetát puffer (2.15.)
Az oszlopon átáramló mozgó fázis áramlási sebességét állítsuk be 2,0±0,5 ml/perc értékre. A detektor hullámhosszát állítsuk 240 nm-re.
4.2.1. Kalibrálás
Minden tartósítószer standard oldatból (2.17.) fecskendezzünk 10-10 μl-t a folyadékkromatográfiás készülékbe (3.2.). A kromatogramokból minden oldatra határozzuk meg a vizsgált tartósítószer csúcsmagasságának a belső standard csúcsmagasságához viszonyított arányát. Az egyes tartósítószerekhez tartozó csúcsmagasságok arányát ábrázoljuk az egyes standard oldatok koncentrációjának függvényében.
Győződjünk meg arról, hogy a kalibrációs eljárás során lineáris görbét kaptunk a standard oldatokra vonatkoztatva.
4.2.2. Mennyiségi meghatározás
Fecskendezzünk 10 μl minta kivonatot (4.1.1.) a folyadékkromatográfiás készülékbe (3.2.), és vegyük fel a kromatogramot. Fecskendezzünk 10 μl tartósítószer standard oldatot (2.1.7.), és vegyük fel a kromatogramot. Hasonlítsuk össze a kapott kromatogramokat. Ha a 2-metoxibenzoesavéval (ajánlott belső standard) nagyjából megegyező retenciós időnél a minta kivonat (4.1.1.) kromatogramján úgy tűnik, hogy nincs csúcs, akkor fecskendezzünk 10 μl belső standarddal ellátott minta kivonatot (4.1.2.) a folyadékkromatográfiás készülékbe, és vegyük fel a kromatogramot.
Ha a 2-metoxibenzoesavéval nagyjából megegyező retenciós időnél zavaró csúcsot találunk a minta kivonat (4.1.1.) kromatogramján, akkor egy másik megfelelő belső standardot kell választani. (Ha a vizsgált tartósítószerek egyike hiányzik a kromatogramról, akkor ez a tartósítószer használható fel belső standardként.)
Győződjünk meg arról, hogy a standard oldatra és a mintaoldatra kapott kromatogramok kielégítik a következő elvárásokat:
– A csúcsszétválásánál a leggyengébben szétvált párnak legalább 0,90-nek kell lennie. (A csúcsszétválás definícióját lásd az 1. ábrán).
1. ábra: Csúcsszétválás
– Ha a szükséges szétválást nem értük el, akkor vagy egy hatékonyabb oszlopot kell használni, vagy a mozgó fázis összetételét addig kell változtatni, amíg a csúcs szétválása megfelelő nem lesz.
– Minden kapott csúcs As aszimmetria faktorának a 0,9–1,5 közötti tartományban kell lennie. (A csúcsaszimmetria-faktor definícióját lásd a 2. ábrán). Az aszimmetria-faktor meghatározására szolgáló kromatogram felvételéhez legalább 2 cm/perc papíradagolási sebesség ajánlott.
– Stabil alapvonalat kell kapnunk
2. ábra: Csúcsaszimmetria-faktor
5. Számítás
A mintaoldatban lévő tartósítószerek koncentrációjának kiszámításához használjuk a vizsgált tartósítószerek csúcsmagasságának a 2-metoxibenzoesav (belső standard) csúcsmagasságához viszonyított arányait és a kalibrációs görbét. A következő képlet segítségével számítsuk ki a minta benzoesav, 4-hidroxibenzoesav, szorbinsav vagy szalicilsav tartalmát tömegszázalékban (xi):
| xi% (m/m) = | 100 · 20 · b ───── 106 · a | = | b ── 500 | · a, |
ahol:
a = a vizsgálati minta (4.1.2.) tömege (g),
b = a kivont mintában (4.1.2.) lévő tartósítószer koncentráció (μg/ml) a kalibrációs görbe alapján.
6. Megismételhetőség *
0,40% 4-hidroxibenzoesav tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,035%-ot.
0,50% benzoesav tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredménye közötti különbség abszolút értéke nem haladhatja meg a 0,050%-ot.
0,50% szalicilsav tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás eredménye közötti különbség abszolút értéke nem haladhatja meg a 0,045%-ot.
0,60% szorbinsav tartalom esetén azonos mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,035%-ot.
7. Megjegyzések
7.1. A módszerrel végzett vizsgálat eredményeinek egyenetlensége azt jelzi, hogy a mintából történő savas kivonásnál az adagolt kénsav mennyiségét az előírt határokon belül kell tartani, a kritikus és a feldolgozott minta mennyiségére vonatkoztatva
7.2. Ha szükséges egy megfelelő védőoszlop (előtét oszlop) is használható.
1. Cél és alkalmazási terület
Ez a módszer a kozmetikai termékekben legfeljebb 2% (m/m) koncentrációban jelen lévő propionsav meghatározására alkalmas.
2. Fogalommeghatározás
Az e módszerrel mért propionsav koncentrációt a termék tömegszázalékában (% m/m) fejezzük ki.
3. Alapelv
A propionsavnak a termékből történt savas kivonását követően a meghatározást gázkromatográfiával végezzük 2-metilpropionsav belső standard felhasználásával.
4. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie; desztillált vizet vagy ennek megfelelő minőségű vizet kell alkalmazni.
4.1. Etil-alkohol, 96%-os (v/v)
4.2. Propionsav
4.3. 2-metil-propionsav
4.4. Ortofoszforsav, 10%-os (m/v)
4.5. Propionsav oldat
Pontosan mérjünk be körülbelül 1,00 g (pgramm)propionsavat egy 50 ml-es mérőlombikba és töltsük fel a jelig etil-alkohollal (4.1.).
4.6. Belső standard oldat
Pontosan mérjünk be mintegy 1,00 g (e gramm) 2-metilpropionsavat egy 50 ml-es mérőlombikba, és töltsük fel jelig etil-alkohollal (4.1.).
5. Eszközök
5.1. Normál laboratóriumi berendezések és:
5.2. Lángionizációs detektorral felszerelt gázkromatográf
5.3. Üvegcső (20x150 mm) csavaros kupakkal
5.4. Vízfürdő, 60 °C-os
5.5. 10 ml-es üvegfecskendő szűrőmembránnal (pórus átmérő: 0,45 μm)
6. Eljárás
6.1 Minta-előkészítés
6.1.1. A minta előkészítése belső standard hozzáadása nélkül
Mérjünk be mintegy 1 g-nyi (a gramm) mintát egy üvegcsőbe (5.3.). Adjunk hozzá 0,5 ml foszforsavat (4.4.) és 9,5 ml etil-alkoholt (4.1.).
Zárjuk le a csövet és erősen rázzuk fel. Ha szükséges, tegyük a csövet 60 °C-ra melegített vízfürdőbe (5.4.) 5 percre, a lipid fázis teljes feloldódása érdekében. Gyorsan hűtsük le vízsugár alatt. Az oldat egy részét szűrjük le membránszűrőn (5.5.). A szűrletet ugyanazon a napon kromatografáljuk.
6.1.2. A minta előkészítése belső standard hozzáadásával
Mérjünk be 1±0,1 g (a gramm) mintát három tizedes pontossággal egy üvegcsőbe (5.3.).
Adjunk hozzá 0,5 ml foszforsavat (4.4.), 0,50 ml belső standard oldatot (4.6.) és 9 ml etil-alkoholt (4.1.)
Zárjuk le a csövet és erősen rázzuk fel. Ha szükséges, tegyük a csövet 60 °C-ra melegített vízfürdőbe (5.4.) 5 percre, a lipid fázis teljes feloldódása érdekében. Gyorsan hűtsük le vízsugár alatt. Az oldat egy részét szűrjük le membránszűrőn (5.5.). A szűrletet ugyanazon a napon kromatografáljuk.
6.2. A gázkromatográfia körülményei
A következő üzemeltetési körülmények ajánlottak:
Oszlop
| Típus: | rozsdamentes acél | |
| Hossz | 2 m | |
| Átmérő | 1/8" | |
| Töltet | 10% SPTM 1000 (vagy ezzel egyenértékű) + 1% H3PO4 Kromoszorb WAW tölteten, szemcseméret: 100–120 mesh |
Hőmérséklet
| Injektor | 200 °C | |
| Oszlop | 120 °C | |
| Detektor | 200 °C | |
| Vivőgáz | nitrogén | |
| Áramlási sebesség | 25 ml/perc |
6.3. Kromatográfia
6.3.1. Kalibrálás
Pipettával csepegtessünk egy 20 ml-es mérőlombik sorozatba 0,25; 0,50; 1,00; 2,00 és 4,00 ml propionsav oldatot (4.5.). Mindegyik mérőlombikba pipettával csepegtessünk 1,00 ml belső standard oldatot (4.6.); töltsük fel őket a jelig etil-alkohollal (4.1.) és keverjük össze. Az így készített oldatok tartalmaznak „e” mg/ ml 2-metilpropionsavat, mint belső standardot (azaz 1 mg/ml-t ha e=1000) és p/4, p/2, p, 2p, 4p mg/ml propionsavat (azaz 0,25; 0,50; 1,00; 2,00; 4,00 mg/ml-t ha p=1000).
Fecskendezzünk mindegyik oldatból 1 μl-t és vegyük fel a kalibrációs görbét úgy, hogy a propionsav/2-metilpropionsav tömegének arányát az x-tengelyen, míg a megfelelő csúcsterületeket az y-tengelyen ábrázoljuk.
Minden oldattal végezzünk három befecskendezést, és számítsuk ki az átlagos csúcsterület arányt.
6.3.2. Mennyiségi meghatározás
Fecskendezzünk 1 μl minta szűrletet (6.1.1.). Hasonlítsuk össze a kromatogramot a standard oldatok (6.3.1.) kromatogramjaival. Ha a csúcsnak hozzávetőlegesen ugyanaz a retenciós ideje mint a 2-metilpropionsavé, akkor váltsunk belső standardot. Ha zavaró hatást nem tapasztalunk, fecskendezzünk 1 μl minta szűrletet (6.1.2.), és mérjük meg a propionsav csúcsterületét, illetve a belső standard csúcsterületét.
Minden oldattal végezzünk három-három befecskendezést és számítsuk ki az átlagos csúcsterület arányt.
7. Számítás
7.1. A 6.3.1. pontban felvett kalibrációs görbéről olvassuk le a 6.3.2. pontban kiszámított csúcsterület aránynak megfelelő tömegarányt (K).
7.2. Az így kapott tömegarányból számítsuk ki a minta propionsav tartalmát (X) tömegszázalékban a következő képlet segítségével:
| x% (m/m) = K | 0,5 · 100 · e ───── 50 · a | = K | e ─ a | , |
ahol:
K = a 7.1. pontban kiszámított arány,
e = a 4.6. pontban bemért belső standard tömege grammban,
a = a 6.1.2. pontban bemért vizsgálati minta tömege grammban.
Az eredményeket kerekítsük fel egy tizedes értékre.
8. Megismételhetőség *
2% propionsav tartalom esetén az ugyanazon a mintán párhuzamosan végzett két mennyiségi meghatározás közötti különbség értéke nem haladhatja meg a 0,12%-ot.
1. Cél és alkalmazási terület
Ez a módszer a bőrt világosító kozmetikai termékekben lévő hidrokinon, hidrokinon monometil-éter, hidrokinon monoetil-éter és hidrokinon monobenzil-éter (monobenzon) kimutatását és azonosítását írja le.
2. Eljárás
A hidrokinont és étereit vékonyréteg kromatográfiával (TLC) azonosítjuk.
3. Reagensek
Minden reagensnek analitikai tisztaságúnak kell lennie.
3.1. Etil-alkohol, 96%-os (v/v)
3.2. Kloroform
3.3. Dietil-éter
3.4. Futtató oldat:
Kloroform / Dietil-éter, 66:33 (v/v)
3.5. Ammónia, 25%-os (m/m) (d420 = 0,91 g/ml)
3.6. Aszkorbinsav
3.7. Hidrokinon
3.8. Hidrokinon monometil-éter
3.9. Hidrokinon monoetil-éter
3.10. Hidrokinon monobenzil-éter (monobenzon)
3.11. Referenciaoldatok
A következő referenciaoldatokat frissen kell elkészíteni és egy napig stabilak.
3.11.1. Mérjünk be 0,05 g hidrokinont (3.7.) egy 10 ml-es, osztással ellátott kémcsőbe. Adjunk hozzá 0,250 g aszkorbinsavat (3.6.) és 5 ml etil-alkoholt (3.1.). Adjunk hozzá ammóniát (3.5.) addig, amíg a pH értéke 10 lesz, és töltsük fel 10 ml térfogatra etil-alkohollal (3.1.).
3.11.2. Mérjünk be 0,05 g hidrokinon monometil-étert (3.8.) egy 10 ml-es, osztással ellátott vizsgálócsőbe. Adjunk hozzá 0,250 g aszkorbinsavat (3.6.) és 5 ml etil-alkoholt (3.1.). Adjunk hozzá ammóniát (3.5.) addig, amíg a pH értéke 10 lesz és töltsük fel 10 ml térfogatra etil-alkohollal (3.1.).
3.11.3. Mérjünk be 0,05 g hidrokinon monoetil-étert (3.9.) egy 10 ml-es, osztással ellátott vizsgálócsőbe. Adjunk hozzá 0,250 g aszkorbinsavat (3.6.) és 5 ml etil-alkoholt (3.1.). Adjunk hozzá ammóniát (3.5.) addig, amíg a pH értéke 10 lesz, és töltsük fel 10 ml térfogatra etil-alkohollal (3.1.).
3.11.4. Mérjünk be 0,05 g hidrokinon monobenzil-étert (3.10.) egy 10 ml-es, osztással ellátott kémcsőbe. Adjunk hozzá 0,250 g aszkorbinsavat (3.6.) és 5 ml etil-alkoholt (3.1.). Adjunk hozzá ammóniát (3.5.) addig, amíg a pH értéke 10 lesz és töltsük fel 10 ml térfogatra etil-alkohollal (3.1.).
3.12. Ezüst-nitrát
3.13. 12-molibdo-foszfát
3.14. Kálium-ferricianid hexahidrát
3.15. Ferriklorid hexahidrát
3.16. Aeroszolos előhívószerek
3.16.1. Egy 5%-os (m/v) ezüst-nitrát vizes oldathoz (3.12.) adjunk ammóniát (3.5.) addig, amíg a keletkezett csapadék feloldódik.
Vigyázat: az oldat állás közben robbanásszerűen instabillá válik, és használat után ki kell önteni.
3.16.2. 10%-os (m/v) 12-molibdo-foszfát (3.13.) etil-alkoholos (3.1.) oldata.
3.16.3. Készítsünk egy 1%-os (m/v) kálium-ferricianid (3.14.) vizes oldatot és egy 2%-os (m/v) ferriklorid (3.15.) vizes oldatot. Közvetlenül felhasználás előtt keverjünk össze azonos mennyiséget a két oldatból.
4. Eszközök
Szokásos laboratóriumi felszerelés
4.1. Szokásos TLC berendezés
4.2. Készgyártmányú TLC lemezek; szilikagél GHR/UV254; 20x20 cm (Macgery, Nagel vagy ezzel egyenértékű)
4.3. Ultrahangos fürdő
4.4. Centrifuga
4.5. UV lámpa, 254 nm
5. Eljárás
5.1. Minta-előkészítés
Mérjünk be 3,0 g mintát egy 10 ml-es, osztással ellátott kémcsőbe (3.8.). Adjunk hozzá 0,250 g aszkorbinsavat (3.6.) és 5 ml etil-alkoholt (3.1.). Állítsuk be az oldat pH-ját 10-re ammónia-oldattal (3.6.). Töltsük fel 10 ml-re etil-alkohollal (3.1.). Dugóval zárjuk le a csövet és homogenizáljuk ultrahangos fürdőben 10 percig. Szűrjük át egy szűrőpapíron vagy centrifugáljuk le 3000-es fordulatszámon.
5.2. TLC
5.2.1. Töltsük fel a kromatográfiás kádat futtató oldattal (3.4.).
5.2.2. Vigyünk fel a lemezre 2 μl referenciaoldatot (3.11.) és 2 μl mintaoldatot (5.1.). A futtatást sötétben végezzük szobahőmérsékleten addig, amíg az oldószer front 15 cm-re eltávolodik az alapvonaltól.
5.2.3. Vegyük ki a lemezt, és szobahőmérsékleten hagyjuk száradni.
5.3. Előhívás
5.3.1. Vizsgáljuk meg a lemezt UV fény alatt 254 nm-en, és jelöljük meg a foltokat.
5.3.2. Permetezzük le a lemezt a következő anyagokkal:
– ezüst-nitrát reagens (3.16.1.), vagy
– 12-molibdo-foszforsav (3.16.2.); melegítsük fel hozzávetőlegesen 120 °C-ra, vagy
– kálium-ferricianid oldat és ferriklorid oldat (3.16.3.)
6. Azonosítás
Számítsuk ki az Rf értéket minden egyes foltra.
Hasonlítsuk össze a mintára kapott foltokat a referenciaoldatokra kapott foltokkal a következő szempontok szerint; Rf értékek, a foltok színe az UV sugárzás alatt; valamint a foltok színe a permetező reagenssel végzett előhívás után.
Végezzük el a következő B szakaszban leírt HPLC vizsgálatot, és hasonlítsuk össze a minta csúcs(ok)ra kapott retenciós időket a referenciaoldatokra kapottakkal.
Vessük össze a TLC és a HPLC vizsgálatok eredményeit, hogy azonosítsuk a hidrokinont és/vagy annak étereit.
7. Megjegyzések
A leírt körülmények között a következő Rf értékek adódnak:
| hidrokinon: | 0,32 | |
| hidrokinon monometil-éter: | 0,53 | |
| hidrokinon monoetil-éter: | 0,55 | |
| hidrokinon monobenzil-éter: | 0,58 |
1. Cél és alkalmazási terület
Ez a módszer a bőrt világosító, a kozmetikai termékekben lévő hidrokinon, hidrokinon monometil-éter, hidrokinon monoetil-éter és hidrokinon monobenzil-éter (monobenzon) meghatározására állapít meg eljárást.
2. Eljárás
A mintát víz/metil-alkohol eleggyel kivonjuk enyhe melegítés közben, hogy a lipid anyagok megolvadjanak. Az elemzett komponensek meghatározását az így kapott oldatból fordított fázisú folyadékkromatográfiával, UV detektálással végezzük.
3. Reagensek
3.1. Minden reagensnek analitikai tisztaságúnak kell lennie. A felhasznált víznek desztillált víznek vagy legalább ezzel megegyező tisztaságú víznek kell lennie.
3.2. Metil-alkohol
3.3. Hidrokinon
3.4. Hidrokinon monometil-éter
3.5. Hidrokinon monoetil-éter
3.6. Hidrokinon monobenzil-éter (monobenzon)
3.7. Tetrahidrofurán, HPLC minőségű
3.8. Víz/metil-alkohol elegy 1:1 (v/v). Elegyítsünk egy térfogatrész vizet és egy térfogatrész metil-alkoholt (3.2.).
3.9. Mozgó fázis: tetrahidrofurán/víz elegy 45:55 (v/v). Elegyítsünk 45 térfogatrész tetrahidrofuránt (3.7.) 55 térfogatrész vízzel
3.10. Referenciaoldat
Mérjünk be 0,06 g hidrokinont (3.3.), 0,08 g hidrokinon monometil-étert (3.4.), 0,10 g hidrokinon monoetil-étert (3.5.) és 0,12 g hidrokinon monobenzil-étert (3.6.) egy 50 ml-es mérőlombikba. Oldjuk fel és töltsük jelig metil-alkohollal (3.2.). Készítsünk referenciaoldatot úgy, hogy ebből az oldatból 10,00 ml-t hígítunk fel 50,00 ml-re víz/etil-alkohol eleggyel (3.8.). Ezeket az oldatokat frissen kell elkészíteni.
4. Eszközök
Szokásos laboratóriumi felszerelés, és:
4.1. 60 °C-os hőmérséklet tartására megfelelő vízfürdő
4.2. Nagynyomású folyadékkromatográf változtatható hullámhosszú UV detektorral és 10 μl-es fecskendező hurokkal
4.3. Analitikai oszlop
Rozsdamentes acél, 250 mm hosszú, belső átmérő 4,6 mm, Zorbax fenil-lel (Zorbax SIL-en kémiailag megkötött fenetil-szilán, a végén trimetilklór-szilánnal bedugaszolva) töltve, szemcsemérete 6 μm, vagy ezzel egyenértékű. Ne használjunk védőoszlopot, kivéve feniles védőoszlopot vagy ezzel egyenértékűt.
4.4. Szűrőpapír, 90 mm átmérőjű, Schleicher és Schull, Weissband 5892 vagy ezzel egyenértékű
5. Eljárás
5.1. Minta-előkészítés
Mérjünk be három tizedes pontossággal 1±0,1 g-nyi (a gramm) mintát egy 50 ml-es mérőlombikba. Diszpergáljuk a mintát 25 ml víz/metil-alkohol elegyben (3.8.). Zárjuk le a lombikot és rázzuk erősen addig, amíg homogén szuszpenziót kapunk. Legalább egy percig rázzuk. Tegyük a lombikot vízfürdőbe (4.1.) és tartsuk 60 °C-on hogy elősegítsük az kivonást. Hűtsük le a lombikot és töltsük fel jelig víz/metil-alkohol eleggyel (3.8.). Szűrőpapíron (4.4.) keresztül szűrjük le a kivonatot. Az kivonat elkészítésétől számított 24 órán belül végezzük el a HPLC-s meghatározást.
5.2. Nagynyomású folyadékkromatográfia
5.2.1. A mozgó fázis (3.9.) áramlási sebességét 1,0 ml/perc értékre, a detektor hullámhosszát 295 nm-re állítsuk be.
5.2.2. Fecskendezzünk az 5.1. pontban leírtak szerinti 10 μl mintaoldatot, és rögzítsük a kromatogramot. Mérjük meg a csúcsterületeket és az 5.2.3. pontban leírtak szerint végezzük el a kalibrálást. Hasonlítsuk össze a minta- és a standard oldatokra kapott kromatogramokat. A csúcsterületeket és az 5.2.3. pontban kiszámolt arányossági tényezőket (RF) használjuk arra, hogy kiszámítsuk a mintaoldat komponenseinek koncentrációját.
5.2.3. Kalibrálás
Fecskendezzünk 10 μl referenciaoldatot (3.10.) és rögzítsük a kromatogramot. Fecskendezzünk még néhányszor addig, amíg állandó csúcsterületet kapunk.
Határozzuk meg az arányossági tényezőt: RFi
| RFi = | Pi ─ ci | , |
ahol:
pi = a hidrokinon, hidrokinon monometil-éter, hidrokinon monoetil-éter vagy hidrokinon monobenzil-éter csúcsterülete, és
ci = a hidrokinon, hidrokinon monometil-éter, hidrokinon monoetil-éter vagy hidrokinon monobenzil-éter referenciaoldatainak (3.10.) koncentrációja (g/50 ml).
Győződjünk meg arról, hogy a standard oldatra és a mintaoldatra kapott kromatogramok kielégítik a következő elvárásokat:
– A csúcsszétválásánál leggyengébben szétvált párnak legalább 0,90-nek kell lennie. (A csúcsszétválás definícióját lásd az 1. ábrán).

1. ábra: Csúcsszétválás
Ha a szükséges szétválást nem értük el, akkor vagy egy hatékonyabb oszlopot kell használni, vagy a mozgó fázis összetételét kell állítgatni addig, amíg a csúcs szétválása nem lesz megfelelő.
– Minden kapott csúcs AS aszimmetria faktorának a 0,9–1,5 közötti tartományban kell lennie. (A csúcsaszimmetria-faktor definícióját lásd a 2. ábrán). Az aszimmetria-faktor meghatározására szolgáló kromatogram felvételéhez legalább 2 cm/perc papíradagolási sebesség ajánlott.

2. ábra: Csúcsaszimmetria faktora
– Stabil alapvonalat kell kapnunk.
6. Számítás
A mintában lévő elemzett komponensek koncentrációinak kiszámítására használjuk a komponensek csúcsterületeit. A minta komponenseinek koncentrációja tömegszázalékban (xi) a következő képlet segítségével számítható ki:
| xi% (m/m) = | bi · 100 ─── RFi · a | , |
ahol:
a = a vizsgált minta tömege (g),
bi = az i-edik komponens csúcsterülete a mintában.
7. Megismételhetőség *
7.1. 2,0% hidrokinon tartalom esetén ugyanazon a mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,13%-ot.
7.2. 1,0% hidrokinon monometil-éter tartalom esetén az ugyanazon a mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,1%-ot.
7.3. 1,0% hidrokinon monoetil-éter tartalom esetén az ugyanazon a mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,11%-ot.
7.4. 1,0% hidrokinon monobenzil-éter tartalom esetén ugyanazon a mintán, párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,11%-ot.
8. Reprodukálhatóság *
8.1. 2,0% hidrokinon-tartalom esetén ugyanazon a mintán, különböző körülmények között (különböző laboratóriumokban, különböző munkatársakkal, különböző készülékkel és/vagy különböző időpontban), párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,37%-ot.
8.2. 1,0% hidrokinon monometil-éter tartalom esetén ugyanazon a mintán, különböző körülmények között (különböző laboratóriumokban, különböző munkatársakkal, különböző készülékkel és/vagy különböző időpontban), párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,21%-ot.
8.3. 1,0% hidrokinon monoetil-éter tartalom esetén ugyanazon a mintán, különböző körülmények között (különböző laboratóriumokban, különböző munkatársakkal, különböző készülékkel és/vagy különböző időpontban), párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,19%-ot.
8.4. 1,0% hidrokinon monobenzil-éter tartalom esetén ugyanazon a mintán, különböző körülmények között (különböző laboratóriumokban, különböző munkatársakkal, különböző készülékkel és/vagy különböző időpontban), párhuzamosan végzett két mennyiségi meghatározás közötti különbség abszolút értéke nem haladhatja meg a 0,11%-ot.
9. Megjegyzések
9.1. Ha a kapott hidrokinon tartalom sokkal magasabb 2%-nál, és a pontos meghatározására van szükség, akkor a minta kivonatát (5.1.) hasonló koncentrációra kell hígítani, mint amilyet egy 2% hidrokinon tartalmú mintára kapnánk. A meghatározást ennek megfelelően meg kell ismételni.
(Néhány műszer esetében a magas hidrokinon koncentrációknál, az abszorbancia kívül eshet a detektor lineáris tartományán.)
9.2. Zavaró hatások
A fent leírt módszer a hidrokinon és étereinek meghatározását teszi lehetővé egyetlen, izokratikus előhívással. A feniloszlop használata biztosítja a hidrokinon megfelelő visszatartását. Ha a leírt mozgó fázissal C18 oszlopot használunk, akkor ez nem garantálható.
Ugyanakkor ennél a módszernél előfordulhat, hogy más vegyületektől eredő hatások zavarják. Ilyen esetekben a meghatározást egy másik mozgó fázis/álló fázis rendszerrel kell megismételni. Megfelelő módszerek találhatók az 1. és 2. lábjegyzetben, azaz:
Oszlop: Zorbax ODS, 4,6 mm x 25 mm, vagy ezzel egyenértékű;
hőmérséklet: 36 °C
áramlási sebesség: 1,5 ml/perc
mozgó fázis:
hidrokinonhoz: metil-alkohol/víz 5/95 (V/V)
hidrokinon monometil-éterhez: metil-alkohol/víz 30/70 (V/V)
hidrokinon monobenzil-éterhez: metil-alkohol/víz 80/20 (V/V) *
Oszlop: Spherisorb S5-ODS, vagy ezzel egyenértékű:
mozgó fázis: víz/metil-alkohol 90/10 (V/V)
áramlási sebesség: 1,5 ml/perc.
Ezek a feltételek hidrokinon meghatározáshoz megfelelőek * .
(A 95/32/EK irányelv alapján)
1. Cél és alkalmazási terület
Ez a módszer egy vékonyréteg-kromatográfiás (TLC) eljárás, amely a B. szakaszban leírt vizsgálati módszerrel együttesen lehetővé teszi a 2-fenoxietanol, 1-fenoxipropán-2-ol, metil-, etil-, propil-, butil- és benzil-4-hidroxibenzoát azonosítását a kozmetikai termékekben.
2. A módszer alapelve
A tartósítószereket acetonnal vonjuk ki a megsavanyított vizsgálati mintából. Szűrés után az acetonos oldatot vízzel elegyítjük, és lúgos közegben a zsírsavakat kalcium sóik formájában csapadékként leválasztjuk. A lúgos aceton/víz elegyből dietil-éterrel kivonjuk a lipofil anyagokat. Savanyítás után a tartósítószereket dietil-éterrel kivonjuk. A dietil-éteres kivonat egy részét szilikagéllel bevont vékonyréteg lemezre cseppentjük. A lemez futtatása után a kapott kromatogramot UV fény alatt vizsgáljuk meg, és a foltokat Millon reagenssel tesszük láthatóvá.
3. Reagensek
3.1. Általános követelmény
Minden reagensnek analitikai tisztaságúnak kell lennie. A felhasznált víz desztillált víz, vagy legalább ezzel egyenértékű tisztaságú víz legyen.
3.2. Aceton
3.3. Dietil-éter
3.4. n-pentán
3.5. Metil-alkohol
3.6. Ecetsav (Jégecet)
3.7. Sósav oldat, 4 mol/l
3.8. Kálium-hidroxid oldat, c(KOH) = 5 mol/l
3.9. Kalcium-klorid dihidrát (CaCl2.2H2O)
3.10. Detektáló szer: Millon reagens
A Millon reagens (higany(II)-nitrát 69820 Fluka (készen, a kereskedelemben beszerezhető oldat)
3.11. 2-Fenoxietanol
3.12. 1-Fenoxipropán-2-ol
3.13. Metil 4-hidroxibenzoát (metilparaben)
3.14. Etil 4-hidroxibenzoát (etilparaben)
3.15. n-Propil 4-hidroxibenzoát (propilparaben)
3.16. n-Butil 4-hidroxibenzoát (butilparaben)
3.17. Benzil 4-hidroxibenzoát (benzilparaben)
3.18. Referenciaoldatok
Készítsünk 0,1%-os (m/v) oldatokat mindegyik referenciaoldatból (3.11., 3.12., 3.13., 3.14., 3.15., 3.16. és 3.17.) metanollal.
3.19. Futtatószer
Elegyítsünk 88 térfogatrész n-pentánt (3.4.) 12 térfogatrész ecetsavat (jégecet) (3.6.).
4. Eszközök
Szokásos laboratóriumi berendezés, és:
4.1. 60 °C hőmérséklet tartására alkalmas vízfürdő
4.2. Futtató kád (szűrőpapír bevonat nélkül)
4.3. Ultraibolya fényforrás, 254 nm
4.4. Vékonyréteg lemezek, 20x20 cm, 0,25 mm 60F254 szilikagéllel bevonva, koncentráló zónával (Merck 11798, Darmstadt, vagy ezzel egyenértékű)
4.5. Maximum 105 °C hőmérséklet tartására alkalmas szárítószekrény
4.6. Meleglevegős hajszárító
4.7. Gyapjú festőhenger, hossza kb. 10 cm, külső átmérője kb. 3,5 cm. A gyapjúréteg vastagsága 2–3 mm. Nyírjuk le a gyapjút, ha szükséges.
Lásd az 5.2. alatti megjegyzést.
4.8. 50 ml-es üvegcső csavaros kupakkal.
4.9. Elektromos fűtőlap termosztátos hőmérséklet-szabályozóval. Hőmérséklet-beállítás: kb. 80 °C. A fűtőlapot fedjük le egy 20x20 cm-es, kb. 6 mm vastagságú alumínium lemezzel, az egyenletes hőeloszlás érdekében.
5. Eljárás
5.1. Minta-előkészítés
Mérjünk be hozzávetőlegesen 1 g mintát egy 50 ml-es csavaros tetejű üvegcsőbe (4.8.). Adjunk hozzá négy csepp sósavat (3.7.) és 40 ml acetont.
Erősen lúgos termékeknél, mint amilyen a pipereszappan, 20 csepp sósav oldatot kell adagolni. Zárjuk le a csövet, óvatosan melegítsük fel az elegyet kb. 60 °C-ra, hogy elősegítsük a tartósítószerek kivonását az acetonos fázisba, majd rázzuk erősen egy percig.
Mérjük meg az oldat pH-ját pH-indikátorpapírral, és állítsuk be ≤3 értékre sósav oldattal. Ismét erősen rázzuk egy percig.
Hűtsük le az oldatot szobahőmérsékletre, és szűrjük át egy szűrőpapíron egy Erlenmeyer lombikba. Töltsünk 20 ml szűrletet egy 200 ml-es Erlenmeyer lombikba, adjunk hozzá 60 ml vizet és keverjük meg. Állítsuk be a pH-t körülbelül 10-es értékre káliumhidroxiddal (3.8.) úgy, hogy a pH mérésére indikátorpapírt használunk.
Adjunk hozzá 1 g kalcium-klorid-dihidrátot (3.9.) és rázzuk fel erősen. Szűrőpapíron szűrjük át egy 250 ml-es Erlenmeyer lombikba, amely 75 ml dietil-étert tartalmaz, és rázzuk erősen egy percig. Hagyjuk szétválni a fázisokat, és a vizes réteget gyűjtsük össze egy 200 ml-es Erlenmeyer lombikba. Indikátorpapír segítségével állítsuk be a vizes oldat pH-ját hozzávetőlegesen 2-re sósav oldattal. Ezt követően adjunk hozzá 10 ml dietil-étert, és rázzuk erősen egy percig. Hagyjuk szétválni a fázisokat, és a dietil-éteres rétegből 2 ml-t töltsük át egy 5 ml-es mintatartó ampullába.
5.2. Vékonyréteg kromatográfia (TLC)
Tegyünk egy TLC lemezt (4.4.) a megmelegített alumínium lapra (4.9.). Minden referenciaoldatból (3.18.) kb. 10 μl-t, a mintaoldatból (5.1.) pedig 100 μl-t vigyünk fel a TLC lemez koncentrációs zónájának alapvonalára.
Ha szükséges, használhatunk légáramot az oldószer párolgásának elősegítésére. Vegyük le a TLC lemezt a melegítőlapról, és hagyjuk lehűlni szobahőmérsékletre. Töltsünk 100 ml előhívó oldószert (3.19.) egy futtató kádba (4.2.).
Tegyük a TLC lemezt azonnal a telítetlen kádba, és szobahőmérsékleten végezzük a futtatást addig, amíg az oldószer front mintegy 15 cm-re eltávolodik az alapvonaltól. Vegyük ki a lemezt a futtató kádból, és szárítsuk meg meleg levegőáramban egy meleglevegős hajszárító segítségével.
Vizsgáljuk meg a lemezt UV fény (4.3.) alatt, és jelöljük be a foltok helyét. Melegítsük a lemezt 30 percig egy szárítószekrényben (4.5.) 100 °C-on a felesleges ecetsav eltávolítása érdekében. A tartósítószereket Millon reagenssel (3.10.) tegyük láthatóvá a kromatogramon úgy, hogy a festőhengert (4.7.) belemerítjük a reagensbe, és addig görgetjük a TLC lemezen, ameddig az egyenletesen benedvesedik.
Megjegyzés: vagylagosan a foltok úgy is láthatóvá tehetők, hogy egy csepp Millon reagenst viszünk fel minden, UV fény alatt kijelölt foltra.
A 4-hidroxibenzoesav észterek piros foltokként, míg az 2-fenoxipropanol és az 1 fenoxipropán-2-ol sárga foltokként jelennek meg. Megjegyezzük ugyanakkor, hogy maga a 4-hidroxibenzoesav, amely a mintában tartósítószerként vagy a parabének bomlástermékeként jelen lehet, ugyancsak vörös foltként fog megjelenni. Lásd a 7.3. és 7.4. pontot.
6. Azonosítás
Számítsuk ki az Rf értéket minden egyes foltra. Hasonlítsuk össze a mintaoldatra kapott foltokat és a referenciaoldatokra kapott foltok Rf értékével, valamint az UV sugárzás, és a láthatóvá tett színük intenzitása szempontjából. Ebből következtetések vonhatók le a tartósítószerek azonosságára vonatkozóan.
Ha úgy tűnik, hogy parabének vannak jelen, akkor a B. szakaszban leírt HPLC vizsgálatot kell végrehajtani. Hasonlítsuk össze a TLC-vel és a nagynyomású folyadékkromatográfiával (HPLC) kapott eredményeket, hogy megerősítsük a 2-fenoxietanol, az 1-fenoxipropán-2-ol és a parabének jelenlétét.
7. Megjegyzések
7.1. A Millon reagens mérgező volta miatt ezt a reagenst a leírt eljárásoknak megfelelően kell használni. Permetezése nem ajánlott.
7.2. Hidroxil-csoportokat tartalmazó egyéb vegyületek is kelthetnek színt Millon reagenssel. N. de Krujif, M. A. H. Rijk, L.A. Pranato-Soetardhi és A. Schouten (1987): Determination of preservatives in cosmetic products I: Thin-layer chromatographic procedure for the identification of preservatives in cosmetic products (J. Chomatography 410, 395–411.) cikkében számos tartósítószerre vonatkozó színtáblázat és a TLC eljárás a használatával kapott Rf értékekre vonatkozó táblázatok találhatóak.
7.3. A következő táblázatban felsorolt Rf-értékek a vizsgálatban kapható értékek azonosítására szolgálnak:
| Vegyület | Rf | Szín | |
| 4-hidroxibenzoesav | 11 | piros | |
| metil-parabén | 12 | piros | |
| etil-parabén | 17 | piros | |
| propil-parabén | 21 | piros | |
| butil-parabén | 26 | piros | |
| benzil-parabén | 16 | piros | |
| 2-fenoxietanol | 29 | sárga | |
| 1-fenoxipropán-2-ol | 50 | sárga |
7.4. A 4-hidroxibenzoesav és metil-parabén vagy a benzil-parabén és etil-parabén esetén nem kapunk szétválást. Ezeknek a vegyületeknek az azonosítását úgy kell elvégezni, hogy a B. szakaszban leírt HPLC vizsgálat értékeit és a mintára kapott retenciós időket egybevetjük a referenciaoldatok retenciós időivel.
1. Cél és alkalmazási terület
Ez a módszer alkalmas a 2-fenoxietanol, 1-fenoxipropán-2-ol, metil 4-hidroxibenzoát, etil-4-hidroxibenzoát, propil-4-hidroxibenzoát, butil-4-hidroxibenzoát és benzil-4-hidroxibenzoát kozmetikai termékekben történő mennyiségi meghatározására.
2. Fogalommeghatározás
Az e módszerrel meghatározott tartósítószerek mennyiségét tömegszázalékban fejezzük ki.
3. Alapelv
A mintát kénsav hozzáadásával megsavanyítjuk, majd etil-alkohol és víz elegyével szuszpendáljuk. Miután a keveréket gyengén melegítettük a lipid fázis megolvasztása és a kvantitatív kivonás elősegítése céljából, a keveréket megszűrjük.
A szűrletben lévő tartósítószereket fordított fázisú HPLC-vel határozzuk meg, belső standardként izopropil-4-hidroxibenzoátot használunk.
4. Reagensek
4.1. Általános rész
Minden reagensnek analitikai és HPLC tisztaságúnak kell lennie ott, ahol erre szükség van. A felhasznált víz desztillált víz, vagy legalább ezzel megegyező tisztaságú víz legyen.
4.2. Abszolút etil-alkohol
4.3. 2-fenoxietanol
4.4. 1-fenoxipropán-2-ol
4.5. Metil-4-hidroxibenzoát (metil-parabén)
4.6. Etil-4-hidroxibenzoát (etil-parabén)
4.7. n-propil-4-hidroxibenzoát (propil-parabén)
4.8. Izopropil-4-hidroxibenzoát (izopropil-parabén)
4.9. n-butil-4-hidroxibenzoát (butil-parabén)
4.10. Benzil-4-hidroxibenzoát (benzilparabén)
4.11. Tetrahidrofurán
4.12. Metil-alkohol
4.13. Acetonitril
4.14. Kénsav oldat c(H2SO4) = 2 mol/l
4.15. Etil-alkohol/víz elegy
Keverjünk össze kilenc térfogatrész etil-alkoholt (4.2.) és egy térfogatrész vizet.
4.16. Belső standard oldat
Pontosan mérjünk be 0,25 g izopropil-parabént (4.8.), töltsük át egy 500 ml-es mérőlombikba, oldjuk fel és töltsük fel a jelig etil-alkohol/víz eleggyel (4.15.).
4.17. Mozgó fázis: tetrahidrofurán/víz/metil-alkohol/acetonitril elegy
Keverjünk össze 5 térfogatrész tetrahidrofuránt, 60 térfogatrész vizet, 10 térfogatrész metil-alkoholt és 25 térfogatrész acetonitrilt.
4.18. Tartósítószerek törzsoldata
Pontosan mérjünk be 0,2 g 2-fenoxietanolt, 0,2 g 1-fenoxipropán-2-ol-t, 0,05 g metilparabént, 0,05 g etil-parabént, 0,05 g propil-parabént, 0,05 g butil-parabént és 0,025 g benzil-parabént egy 100 ml-es mérőlombikba, oldjuk fel és töltsük jelig etil-alkohol/víz eleggyel.
Hűtőszekrényben tartva az oldat egy hétig stabil.
4.19. Tartósítószerek standard oldatai
A törzsoldatból (4.18.) töltsünk át 20,00 ml-t, 10,00 ml-t, 5,00 ml-t, 2,00 ml-t és 1,00 ml-t egy-egy 50 ml-es mérőlombikba. Minden mérőlombikhoz adjunk 10 ml belső standard oldatot (4.16.) és 1,0 ml kénsav oldatot (4.14.), majd töltsük fel a jelig etil-alkohol/víz eleggyel. Ezeket az oldatokat frissen kell készíteni.
5. Eszközök
Hagyományos laboratóriumi felszerelés és:
5.1. 60±1 °C fenntartására alkalmas vízfürdő
5.2. Nagynyomású folyadékkromatográf 280 nm hullámhosszú UV detektorral
5.3. Analitikai oszlop
Rozsdamentes acél, 25 cm x 4,6 mm belső átmérő (vagy 12,5 cm x 4,6 mm belső átmérő), Nucleosil 5C18 vagy ezzel egyenértékű töltettel töltve (lásd a 10.1. pontot)
5.4. 100 ml-es üvegcsövek csavaros kupakkal
5.5. Forrkő, 2–4 mm méretű vagy ezzel egyenértékű
6. Eljárás
6.1. Minta-előkészítés
6.1.1. A minta előkészítése belső standard hozzáadása nélkül
Mérjünk be körülbelül 1 g-nyi mintát egy 100 ml-es csavaros tetejű üvegcsőbe. Pipettázzunk 1,0 ml kénsav oldatot (4.14.) és 50,0 ml etil-alkohol/víz elegyet (4.15.) a csőbe. Adjunk hozzá körülbelül 1 g forrkövet (5.5.), zárjuk le a csövet és rázzuk erősen addig, amíg homogén szuszpenziót nem kapunk. Rázzuk legalább egy percig. Tegyük a csövet öt percre vízfürdőbe (5.1.), és tartsuk 60±1 °C-on a tartósítószerek etil-alkoholos fázisba történő kivonásának elősegítése céljából.
Azonnal hűtsük le a csövet hideg vízáramban és tartsuk a kivonatot hűtőszekrényben egy órán keresztül. Szűrjük le a kivonatot szűrőpapíron keresztül. Töltsünk át körülbelül 2 ml kivonatot egy 5 ml-es mintatartó küvettába. Tartsuk a kivonatot hűtőszekrényben és 24 órán belül végezzük el a HPLC-s meghatározást.
6.1.2. A minta előkészítése belső standard hozzáadásával
Mérjünk be három tizedes pontossággal 1±0,1 g mintát egy 100 ml-es csavaros tetejű üvegcsőbe.
Pipettázzunk 1,0 ml kénsav oldatot és 40,0 ml etil-alkohol/víz elegyet a csőbe. Adjunk hozzá körülbelül 1 g forrkövet (5.5.) és pontosan 10,00 ml belső standard oldatot. Zárjuk le a csövet, és rázzuk erősen addig, amíg homogén szuszpenziót nem kapunk. Rázzuk legalább egy percig. Tegyük a csövet öt percre vízfürdőbe (5.1.), és tartsuk 60±1 °C-on a tartósítószerek etil-alkoholos fázisba történő kivonásának elősegítése céljából.
Azonnal hűtsük le a csövet hideg vízáramban és tartsuk a kivonatot hűtőszekrényben egy órán keresztül. Szűrjük le a kivonatot szűrőpapíron keresztül.
Töltsünk át körülbelül 2 ml kivonatot egy 5 ml-es mintatartó küvettába (vakoldat). Tartsuk a kivonatot hűtőszekrényben, és 24 órán belül végezzük el a HPLC-s meghatározást.
6.2. Nagynyomású folyadékkromatográfia (HPLC)
6.2.1. Kromatografálási feltételek:
– Mozgó fázis: tetrahidrofurán/víz/metil-alkohol/acetonitril elegy (4.17.)
– Áramlási sebesség: 1,5 ml/perc
– A detektálás hullámhossza: 280 nm
6.2.2. Kalibrálás
Minden tartósítószer standard oldatából (4.19.) inyjektáljunk 10 μl-t. A kapott kromatogramokból határozzuk meg a vizsgált tartósítószer standard oldat csúcsmagasságának a belső standard csúcsmagasságához viszonyított arányát. Ábrázoljuk görbén az egyes tartósítószerekhez tartozó csúcsmagasságok arányát az egyes standard oldatok koncentrációjának függvényében.
6.2.3. Mennyiségi meghatározás
Fecskendezzünk 10 μl belső standard nélküli mintaoldatot (6.1.1.) a kromatográfba, és vegyük fel a kromatogramot.
Fecskendezzünk az egyik tartósítószer standard oldatból (4.19.) 10 μl-t, és vegyük fel a kromatogramot. Hasonlítsuk össze a kapott kromatogramokat.
Ha a minta kivonat (6.1.1.) kromatogramján nincs csúcs, vagy a csúcs nem válik szét nagyjából ugyanannál a retenciós időnél, mint az izopropil-parabének (ajánlott belső standard), akkor folytassuk azzal, hogy fecskendezzünk be 10 μl belső standardot tartalmazó minta kivonatot (6.1.2.). Vegyük fel a kromatogramot, és mérjük meg a csúcsmagasságokat.
Ha zavaró csúcsot találunk a minta kivonatának kromatogramján ugyanannál a retenciós időnél, mint az izopropil-parabén, akkor egy másik megfelelő belső standardot kell választani.
Ha a vizsgált tartósítószerek egyike hiányzik a kromatogramról, akkor ez a tartósítószer használható fel belső standardként.
Számítsuk ki a vizsgált tartósítószerek csúcsmagasságainak a belső standard csúcsmagasságaihoz viszonyított arányát.
Győződjünk meg arról, hogy kalibrálásnál a felhasznált belső standardokra lineáris görbét kaptunk-e.
Győződjünk meg arról, hogy a tartósítószerek standard oldatára és a mintaoldatra kapott kromatogramok kielégítik-e a következő elvárásokat:
A csúcsszétválásánál a leggyengébben szétvált párnak legalább 0,90-nek kell lennie.
csúcsszétválás p = f/g
1. ábra: Csúcsszétválás
Aszimmetria-faktor
As = b/a
Ha a szükséges szétválást nem értük el, akkor vagy egy hatékonyabb oszlopot kell használni, vagy a mozgó fázis összetételét addig kell változtatni, amíg az az elvárásokat kielégíti.
– Minden kapott csúcs AS aszimmetria faktorának 0,9–1,5 közötti tartományban kell lennie. (A csúcsaszimmetria-faktor definícióját lásd a 2. ábrán). Az aszimmetria-faktor meghatározására szolgáló kromatogram felvételéhez legalább 2 cm/perc papíradagolási sebesség ajánlott.
2. ábra: Csúcsaszimmetria-faktor
– Stabil alapvonalat kell kapnunk.
7. Számítás
Használjuk a kalibrációs görbét (6.2.2.) és a vizsgált tartósítószerek csúcsmagasságának a belső standard csúcsmagasságához viszonyított arányait a mintaoldatban lévő tartósítószerek koncentrációjának kiszámításához. Számítsuk ki a minta 2-fenoxietanol, 1-fenoxipropán-2-ol, metil 4-hidroxibenzoát, etil-4-hidroxibenzoát, propil-4-hidroxibenzoát, butil-4-hidroxibenzoát és benzil-4-hidroxibenzoát tartalmát (wi) tömegszázalékban (%m/m) a következő képlet segítségével:
| %wi (m/m) = | bi ─── 200 x a | , |
ahol:
b = a vakoldatban lévő i-edik tartósítószer koncentrációja (μg/ml) a kalibrációs görbe alapján, és
a = a vizsgált adag tömege (g).
8. Megismételhetőség *
Lásd a megjegyzések 10.5. pontját.
9. Reprodukálhatóság *
Lásd a megjegyzések 10.5. pontját.
10. Megjegyzések
10.1. Álló fázis
HPLC meghatározásoknál az oldatok retenciós viselkedése erősen függ az álló fázis típusától, márkájától és előéletétől. Azt, hogy egy oszlop használható-e a vizsgált tartósítószerek szétválasztására, a standard oldatokra kapott eredményekből tudjuk megállapítani (lásd a megjegyzések 6.2.3. pontját). A javasolt töltőanyagon kívül a Hypersil ODS és a Zorbax ODS is ugyanúgy használható.
Vagylagosan az ajánlott mozgó fázis összetételét lehet optimalizálni az elvárt szétválasztás elérése érdekében.
10.2. A detektálás hullámhossza
A leírt módszerrel végzett egyenetlenségi vizsgálat azt mutatta, hogy a detektálás hullámhosszának kismértékű megváltozása jelentős hatással bír a meghatározás eredményeire.
Ezért ezt a paramétert az elemzés során igen alaposan kell szabályozni.
10.3. Zavaró hatások
Az ebben a módszerben leírt körülmények között sok más vegyület, mint például tartósítószerek és kozmetikai adalékanyagok is kioldódnak. A kozmetikai termékekről szóló tanácsi irányelvhez tartozó VI. mellékletben említett nagyszámú tartósítószer retenciós ideje fel van sorolva N. de Kruijf, M.A.H. Rijk, L.A. Pranato-Soetardhi and Schouten, (1989): Determination of preservatives in cosmetic products II. Highperformance liquid chromatographic identification (J. Chromatography 469, 317–398) cikkében.
10.4. Az analitikai oszlop védelmére egy megfelelő előtétoszlop is használható.
10.5. A módszert egy együttműködési kísérlet során vizsgálták, amelyben kilenc laboratórium vett részt. Három mintát vizsgáltak. A következő táblázat mindhárom mintára felsorolja a vizsgált mintákra kapott % m/m átlagokat (m), a megismételhetőségeket (r) és a reprodukálhatóságokat (R):
| Minta | 2-Fenoxi-etanol | 1-Fenoxi- propán- 2-ol | Metil- parabén | Etil- parabén | Propil- parabén | Butil- parabén | Benzil- parabén | ||
| Vitamin krém | m | 1,124 | 0,250 | 0,0628 | 0,031 | 0,0906 | |||
| r | 0,016 | 0,018 | 0,0035 | 0,0028 | 0,0044 | ||||
| R | 0,176 | 0,030 | 0,0068 | 0,0111 | 0,0034 | ||||
| Nappali | m | 1,196 | 0,266 | 0,076 | |||||
| arckrém | r | 0,040 | 0,003 | 0,002 | |||||
| R | 0,147 | 0,022 | 0,004 | ||||||
| Masszázs | m | 0,806 | 0,180 | 0,148 | 0,152 | ||||
| krém | r | 0,067 | 0,034 | 0,013 | 0,015 | ||||
| R | 0,112 | 0,078 | 0,012 | 0,016 | |||||
(A 96/45/EGK irányelv alapján)